
 CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )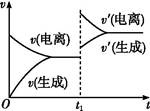
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合前:pH(CH3COOH)+pH(NaOH)=14 |
| B.混合后:c(Na+)=c(CH3COO-)+c(OH-) |
| C.混合前:c(CH3COOH)>c(NaOH) |
| D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
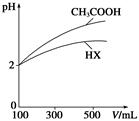
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 3.0×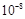 | K1=4.3×10-7 K2=5.6×10-11 |
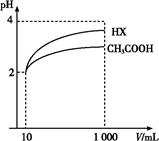
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
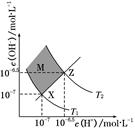
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(B+) |
| B.若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比1∶1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
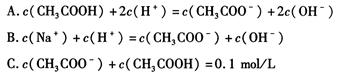
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com