
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
分析 0.lmol•L-1的某一元弱酸溶液电离度为a%,则该溶液中发生电离的一元弱酸的浓度为:0.1mol/L×a%=a×10-3mol/L,由于水的电离程度较小,则该一元弱酸溶液中氢离子浓度约为a×10-3mol/L,然后根据溶液pH的表达式进行计算.
解答 解:某温度下,0.lmol•L-1的某一元弱酸溶液电离度为a%,则该溶液中发生电离的一元弱酸的浓度为:0.1mol/L×a%=a×10-3mol/L,
由于水的电离程度较小,则该一元弱酸溶液中氢离子浓度约为a×10-3mol/L,
所以该溶液的pH=-lga×10-3=3-lga,
故选D.
点评 本题考查了溶液pH的简单计算,题目难度不大,明确电离度的含义为解答关键,注意索座老翁溶液pH的概念及表达式,试题培养了学生的分析、理解能力及化学计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 用浓硝酸与Cu反应制NO2 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | NO2溶于水时发生氧化还原反应 | D. | 过量的铜与浓硝酸反应有N0生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
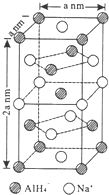 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
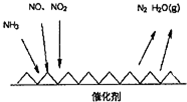
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
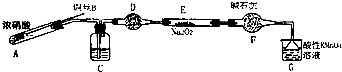 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
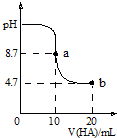 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | pH=7时,c(Na+)=0.05 mol•L-1 | |
| C. | a、b两点溶液中水电离出c(H+)浓度的比值为104 | |
| D. | b点所示溶液中c(A-)<c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com