


科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的水中含有0.5个NA水分子 |
| B、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA |
| C、1mol H2和O2的混合气体中含NA个分子 |
| D、11.2L NH3中所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为:C17H18O6 |
| B、1mol霉酚酸最多与5molH2发生加成反应 |
| C、不能与FeCl3溶液发生显色反应 |
| D、一定条件下 1 mol霉酚酸最多可与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三聚氰胺是劣质蛋白质 |
| B、在检测条件下三聚氰胺可以转化为蛋白质 |
| C、三聚氰胺中氮元素的含量高于蛋白质中氮的含量 |
| D、三聚氰胺及蛋白质中的氮元素在检测条件下可以转化生成相同的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 |
固体中含有Fe2O3 | |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液? | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
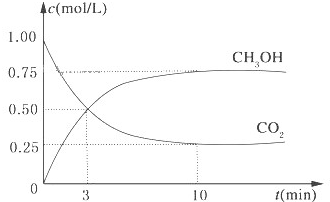 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g?cm-3,则阿伏加德罗常数可表示为( )
测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g?cm-3,则阿伏加德罗常数可表示为( )A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com