
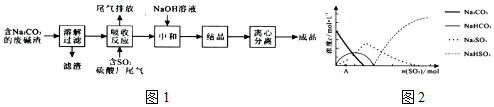
分析 测定样品中的NaCl的质量分数,由流程可知,溶解后加氯化钡除去碳酸钠,沉淀为BaCO3,则最后ng固体为BaCO3,
①检验氯化钡是否过量,取上层溶液,检验钡离子即可;
②检验沉淀是否洗涤干净,取最后一次的洗涤液检验是否含氯离子,结合BaCO3~Na2CO3计算.
解答 解:测定样品中的NaCl的质量分数,由流程可知,溶解后加氯化钡除去碳酸钠,沉淀为BaCO3,则最后ng固体为BaCO3,
①检验氯化钡溶液过量的方法为取少量上层清液于试管中,加入硫酸钠,如果变浑浊则说明氯化钡是过量的,反之则不是过量的,
故答案为:取少量上层清液于试管中,加入硫酸钠,如果变浑浊则说明氯化钡是过量的,反之则不是过量的;
②检验沉淀是否洗涤干净所用到的试剂是AgNO3溶液,样品中NaCl的质量分数的数学表达式为$\frac{mg-\frac{ng}{197g/mol}×106g/mol}{mg}$×100%=1-$\frac{106n}{197m}$,
故答案为:AgNO3溶液;1-$\frac{106n}{197m}$.
点评 本题考查物质含量的测定实验,为高频考点,把握流程中发生的反应、混合物分离、实验技能为解答的关键,侧重分析与实验能力的考查,注意结合碳酸根离子守恒计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.
;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | HY | C. | Y2 O | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中的任意三个原子都不共面 | |
| B. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| C. | 天然气、沼气、坑道气的主要成分均是甲烷 | |
| D. | 丙烷和甲烷一样能与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
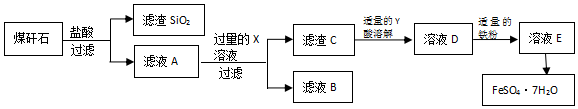
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都约是22.4L | |
| B. | 1mol气态物质,当体积约为22.4L时,该气体一定处于标准状况下 | |
| C. | 在标准状况下,2mol酒精(CH3CH2OH)的体积为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com