
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
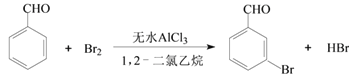
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
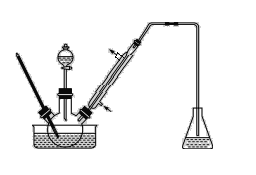
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
【答案】分液漏斗 吸收Br2和HBr(或处理尾气) C Br2 减压蒸馏 间溴苯甲醛因温度过高被氧化 40%
【解析】
因为用热水浴给反应物加热,所以反应物中沸点最低的Br2有一部分可能会成为蒸气与反应生成的HBr一起蒸出。
(1)实验装置中盛装液溴的仪器名称是分液漏斗,锥形瓶中的试剂为NaOH溶液,其作用为吸收蒸气中的Br2和HBr;
(2)步骤1反应过程中,为提高原料利用率,需要适宜的温度,但需控制不让反应物成为蒸气,所以温度不应高于溴的沸点,即58.8℃。
(3)因为有机层中会溶解Br2,所以步骤2中用10% NaHCO3溶液洗涤。
(4)为了防止间溴苯甲醛因温度过高被氧化,步骤4中采用减压蒸馏。
(5) 设5.3g苯甲醛完全反应,能生成间溴苯甲醛的质量为x

106g 185g
5.3g x
X=![]() ,w(间溴苯甲醛)=
,w(间溴苯甲醛)=![]() 。
。
因为加热,所以反应物中沸点最低的Br2有一部分可能会成为蒸气与反应生成的HBr一起蒸气。
(1)实验装置中盛装液溴的仪器名称是分液漏斗,锥形瓶中的试剂为NaOH溶液,其作用为吸收蒸气中的Br2和HBr;答案为:分液漏斗;吸收Br2和HBr(或处理尾气);
(2)步骤1反应过程中,为提高原料利用率,需要适宜的温度,但需控制不让反应物成为蒸气,所以温度不应高于溴的沸点,即58.8℃;答案为:C;
(3)因为有机层中会溶解Br2,所以步骤2中用10% NaHCO3溶液洗涤;答案为:Br2;
(4)为了防止间溴苯甲醛因温度过高被氧化,步骤4中采用减压蒸馏;答案为:减压蒸馏;间溴苯甲醛因温度过高被氧化;
(5) 设5.3g苯甲醛完全反应,能生成间溴苯甲醛的质量为x

106g 185g
5.3g x
X=![]() ,w(间溴苯甲醛)=
,w(间溴苯甲醛)=![]() 。答案为:40%。
。答案为:40%。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下表中的实验操作能达到实验目的或能得出相应结论的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向一定浓度的 |
|
B | 取少量 | 检验 |
C | 向某溶液中滴加 | 说明原溶液中一定含有 |
D | 将混有 | 除去 |
A.A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是三元弱酸,常温下三级电离常数分别是:Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序___(填序号)。
(2)常温下,NaH2PO4的水溶液pH___(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈___(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
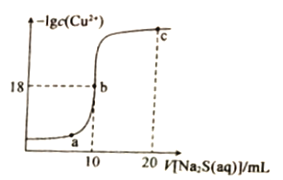
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合液中lgX随pH的变化关系如图所示。下列说法不正确的是( )
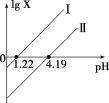
A.线Ⅰ中X表示的是![]()
B.线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH:1.22 < pH < 4.19
D.c(Na+)=c(HC2O4-)+2c(C2O42-)对应溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
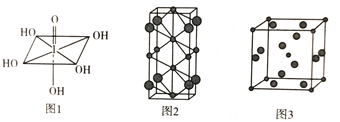
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法
B.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
C.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一些
D.溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待盛液润洗2~3次后方可使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是
①滴定时,装待测溶液的锥形瓶有少量水
②酸式滴定管用蒸馏水洗后,未用标准溶液洗
③滴定终点读数时,仰视
④量取氢氧化钠溶液时,量取前有气泡,量取后气泡消失
A.③B.②③C.②③④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com