
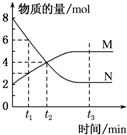
 一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示:分析 (1)根据图知,M是生成物、N是反应物,达到平衡状态时,参加反应的n(M)=(5-2)mol=3mol,n(N)=(8-2)mol=6mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比;
(2)可逆反应达到平衡状态时各物质的物质的量不变;反应速率之比等于其计量数之比;
(3)反应前后气体物质的量改变的可逆反应,当压强不变时该可逆反应达到平衡状态;
(4)升高温度、增大压强、增大气体浓度都能增大反应速率;
(5)反应速率v=$\frac{\frac{△n}{V}}{△t}$.
解答 解:(1)根据图知,M是生成物、N是反应物,达到平衡状态时,参加反应的n(M)=(5-2)mol=3mol,n(N)=(8-2)mol=6mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,所以n(N):n(M)=6mol:3mol=2:1,则该反应方程式为2N?M,故答案为:2N?M;
(2)反应达到平衡状态时,各物质的物质的量不变,根据图知,该反应达到平衡状态的是t3,反应速率之比等于其计量数之比,则N、M的反应速率之比为2:1,
故答案为:t3;2:1;
(3)反应前后气体物质的量改变的可逆反应,当压强不变时该可逆反应达到平衡状态,该反应前后气体物质的量减小,所以反应未达到平衡时压强在不断减小,当压强不变时,该反应达到平衡状态,
故答案为:能;
(4)升高温度、增大压强、增大气体浓度都能增大反应速率,故选A、D;
(5)反应速率v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(8-4)mol}{2L}}{2min}$=1 mol•(L•min)-1 ,
故答案为:1 mol•(L•min)-1 .
点评 本题考查化学平衡有关计算,为高频考点,涉及图象分析、反应速率计算、平衡状态判断等知识点,侧重考查学生分析计算能力,注意:只有反应前后改变的物理量只能作为平衡状态判断依据,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
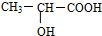 ,回答下列问题:
,回答下列问题: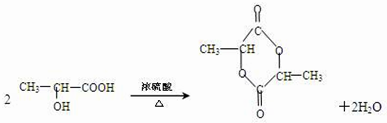
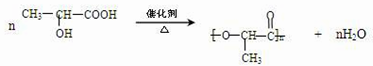
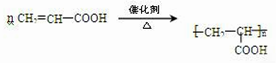 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
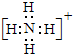
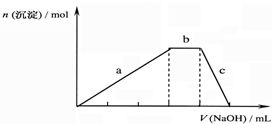
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;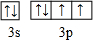 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
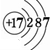 .
.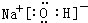 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
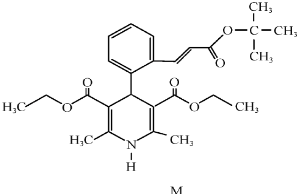
| A. | 属于芳香族化合物 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 1molM完全水解生成2mol醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com