
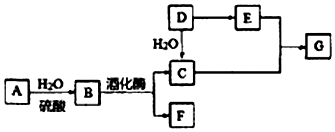
分析 A是天然有机高分子化合物,在酸性条件下水解得B,B在酒化酶的作用下生成C和F,所以A为(C6H10O5)n,B为C6H12O6,G蒸气密度是氢气的44 倍,即G的相对分子质量为88,D是一种重要的化工原料,D与水加成得C,所以C为CH3CH2OH,F为CO2,则D为CH2=CH2,D氧化得E为CH3COOH,C和E发生酯化反应生成G为CH3COOCH2CH3,烃X的相对分子质量是D、F之和,即为72,分子中碳与氢的质量之比是5:1,则X为C5H12,据此答题.
解答 解:A是天然有机高分子化合物,在酸性条件下水解得B,B在酒化酶的作用下生成C和F,所以A为(C6H10O5)n,B为C6H12O6,G蒸气密度是氢气的44 倍,即G的相对分子质量为88,D是一种重要的化工原料,D与水加成得C,所以C为CH3CH2OH,F为CO2,则D为CH2=CH2,D氧化得E为CH3COOH,C和E发生酯化反应生成G为CH3COOCH2CH3,烃X的相对分子质量是D、F之和,即为72,分子中碳与氢的质量之比是5:1,则X为C5H12,
(1)根据上面的分析可知,D为CH2=CH2,D中官能团的名称为碳碳双键,
故答案为:碳碳双键;
(2)C和E发生酯化反应生成CH3COOCH2CH3,反应的化学方程式CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(3)检验A转化过程中有B生成,即检验葡萄糖的存在,先中和水解液,再需要加入的试剂是新制氢氧化铜(或银氨溶液),
故答案为:新制氢氧化铜(或银氨溶液);
(4)X为C5H12,是饱和烷烃,
A.C5H12 不溶于水,与甲烷互为同系物,故A正确;
B.C5H12在高温下会分解,故B错误;
C.C5H12的一种同分异构体为2-甲基丁烷,有三个甲基,故C错误;
D.烷烃和溴水不发生加成反应,故D错误;
故选A.
点评 本题考查有机物的推断,题目难度中等,确定G的组成是解题的关键,结合反应特点利用顺推法、逆推法相结合进行推断,注意掌握常见官能团的性质.


科目:高中化学 来源: 题型:解答题
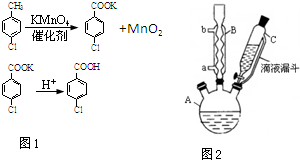 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液:K+、Na+、F-、Br- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com