
| 1 |
| 2 |
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |


科目:高中化学 来源: 题型:
| A、全部 | B、②③④ |
| C、①②④ | D、除①以外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23g钠在氧气中完全燃烧失电子数为0.5NA |
| B、标准状况下,22.4L苯所含的分子数 |
| C、室温下,8g甲烷含有共价键数为2NA |
| D、1L 1mol?L-1硫酸溶液所含的H+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使澄清的石灰水变浑浊的气体可能是SO2 |
| B、能使品红溶液褪色将其煮沸溶液又变红的无色气体一定是SO2 |
| C、某强酸性溶液经分析其中含有大量的S2-,SO32- |
| D、用NaHSO3,Na2SO3与浓硫酸反应都可产生SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳化钙[CaC2]投入水中 |
| B、炽热的焦炭投入浓硝酸中 |
| C、少量的二氧化锰加入双氧水中 |
| D、乙醇和浓硫酸共热至170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、科学使用农药、化肥,减少水体污染 |
| B、工业废水和城市生活污水需净化处理,坚持达标排放 |
| C、为了节约生产成本,可将造纸厂、化工厂建在水源地上游 |
| D、合理开发水资源,建立水资源节约型和环境友好型经济 |
查看答案和解析>>
科目:高中化学 来源: 题型:
70 30 |
208 82 |
277 112 |
1 0 |
| A、上述合成过程中属于化学变化 | ||
| B、Cn元素的相对原子质量为277 | ||
C、
| ||
| D、Cn元素位于元素周期表的第六周期,是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
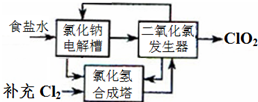 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com