

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为O2+4e-+2H2O=4OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故A错误;
B.因为原电池放电时,阳离子移向正极,所以Li+透过固体电解质向Cu极移动,故B正确;
C.该电池通过一种复杂的铜腐蚀而产生电力,由方程式可知铜电极上并非是氧气直接放电,正极反应为Cu2O+H2O+2e-=Cu+2OH-,故C正确;
D.由C项分析知:铜先与氧气反应生成Cu2O,放电时Cu2O重新生成Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选A.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


科目:高中化学 来源: 题型:解答题
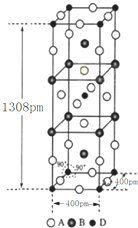 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: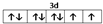 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
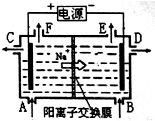
| A. | 标准状况下,生成22.4LCl2的同时有2molNaOH生成 | |
| B. | 从C口流出的是NaOH溶液 | |
| C. | 从E口逸出的气体是H2 | |
| D. | 从F口逸出的气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | 2 min内A的反应速率为0.3 mol/(L•min) | |
| C. | B的转化率为40% | |
| D. | 若混合气体的密度不变,则表明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用水去除硬脂酸钠中的甘油 | |
| C. | 用NaOH溶液除去溴苯中的溴 | |
| D. | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代用铜矿石、锡矿石冶炼铸造青铜器 | |
| B. | 出土后的青铜器大多数已受到锈蚀 | |
| C. | 古代用明矾溶液清除青铜镜表面的锈斑 | |
| D. | 现代用双氧水去除青铜器上有害的CuCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com