
| A. | 非金属性X>Y>Z | |
| B. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| C. | 元素的负化合价的绝对值按X、Y、Z变小 | |
| D. | 原子半径:X>Y>Z |
分析 同周期的X、Y、Z三主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z;
A.同周期自左而右非金属性增强;
B.非金属性越强,最高价含氧酸的酸性越强;
C.最低负化合价=最高正化合价-8;
D.同周期自左而右原子半径减小.
解答 解:同周期的X、Y、Z三主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,故A正确;
B.非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性H3ZO4<H2YO4<HXO4,故B错误;
C.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故C错误;
D.同周期自左而右原子半径减小,故原子半径X<Y<Z,故D错误,
故选A.
点评 本题考查性质与位置关系、元素周期律等,难度不大,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
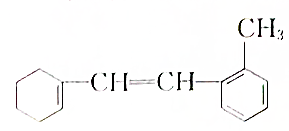 :
:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸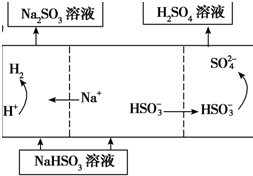 |
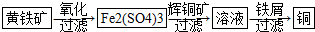
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
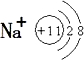 ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.
 ;气体D的结构式
;气体D的结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
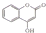 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
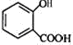 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$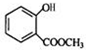 +H2O.
+H2O.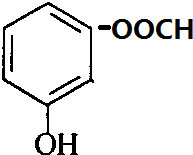 、
、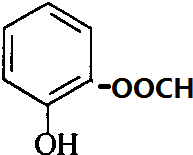 、
、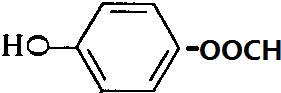 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| C. | 铁质器件附有铜质配件,接触处容易生铁锈 | |
| D. | 银质奖牌放置久了表面变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
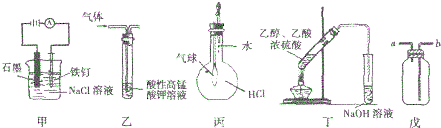
| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com