



 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
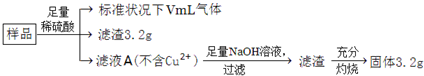
| A、滤液A中阳离子为Fe2+、H+ | B、样品中金属Fe的质量为2.24g | C、样品中CuO的质量为4.0g | D、V=448 |
查看答案和解析>>
科目:高中化学 来源:2010年江苏省扬州市高三第四次模拟考试化学试题 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g D.V=448
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com