
| A£® | ·“Ó¦¢ŁÖŠ»ÆѧÄÜ×Ŗ»ÆĪŖČČÄÜ | |
| B£® | ·“Ó¦¢ŚÖŠČōÉś³ÉŅŗĢ¬ĀĮŌņ·“Ó¦ČČÓ¦“óÓŚ”÷H2 | |
| C£® | ·“Ó¦¢ŪÖŠ1molAlCl3£Øg£©Éś³ÉŹ±£¬ŠčŅŖĪüŹÕ174.9kJµÄČČĮæ | |
| D£® | øĆÉś²ś¹¤ŅÕÖŠÄÜŃ»·ĄūÓƵÄĪļÖŹÖ»ÓŠAlCl3 |
·ÖĪö A£®”÷H1£¾0£¬¹ŹĪŖĪüČČ·“Ó¦£¬¹Ź½«ČČÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ£»
B£®AlÓɹĢĢ¬±äĪŖŅŗĢ¬ĪüČČ£¬ĖłŅŌøĆ·“Ó¦ĪüČČŌö¼Ó£¬Ęä·“Ó¦ČȵÄÖµ“óÓŚ”÷H2£»
C£®ŅŃÖŖ¢ŁAl2O3£Øs£©+3C£Øs£©=2Al£Øs£©+3CO£Øg£©”÷H1=1344.1kJ•mol-1
¢Ś2AlCl3£Øg£©=2Al£Øs£©+3Cl2£Øg£©”÷H2=1169.2kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł-¢ŚæÉµĆ£ŗAl2O3£Øs£©+3C£Øs£©+3Cl2£Øg£©=2AlCl3£Øg£©+3CO£Øg£©£»
D£®øĆÉś²ś¹¤ŅÕÖŠÄÜŃ»·ĄūÓƵÄĪļÖŹAlCl3ŗĶCl2£®
½ā“š ½ā£ŗA£®·“Ó¦¢Ł”÷H1£¾0£¬¹ŹĪŖĪüČČ·“Ó¦£¬¹Ź½«ČČÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ£¬¹ŹA“ķĪó£»
B£®AlÓɹĢĢ¬±äĪŖŅŗĢ¬ĪüČČ£¬ĖłŅŌøĆ·“Ó¦ĪüČČŌö¼Ó£¬Ęä·“Ó¦ČȵÄÖµ“óÓŚ”÷H2£¬¹ŹBÕżČ·£»
C£®ŅŃÖŖ¢ŁAl2O3£Øs£©+3C£Øs£©=2Al£Øs£©+3CO£Øg£©”÷H1=1344.1kJ•mol-1
¢Ś2AlCl3£Øg£©=2Al£Øs£©+3Cl2£Øg£©”÷H2=1169.2kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ł-¢ŚæÉµĆ£ŗAl2O3£Øs£©+3C£Øs£©+3Cl2£Øg£©=2AlCl3£Øg£©+3CO£Øg£©”÷H3=174.9kJ•mol-1£¬¹Ź1molAlCl3£Øg£©Éś³ÉŹ±£¬ŠčŅŖĪüŹÕ$\frac{1}{2}”Į174.9kJ$=87.45KJµÄČČĮ棬¹ŹC“ķĪó£»
D£®øĆÉś²ś¹¤ŅÕÖŠÄÜŃ»·ĄūÓƵÄĪļÖŹAlCl3ŗĶCl2£¬¹ŹD“ķĪó£¬
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éÄÜĮæµÄ×Ŗ»Æ£¬·“Ó¦ČȵÄÅŠ¶Ļ£¬·“Ó¦ČČµÄ¼ĘĖć£¬Ń»·ĪļÖŹµÄÅŠ¶Ļ£¬±¾ĢāÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ņ»¶ØŹōÓŚ·Ö½ā·“Ó¦ | B£® | Ņ»¶ØŹōÓŚŃõ»Æ»¹Ō·“Ó¦ | ||
| C£® | Ņ»¶ØŹōÓŚ·ÅČČ·“Ó¦ | D£® | Ņ»¶ØŹōÓŚæÉÄę·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »Æѧ¼üŹĒŅ»ÖÖ×÷ÓĆĮ¦ | |
| B£® | »Æѧ¼üæÉŅŌŹ¹Ō×ÓĻą½įŗĻ£¬Ņ²æÉŅŌŹ¹Ąė×ÓĻą½įŗĻ | |
| C£® | »Æѧ·“Ó¦¹ż³ĢÖŠ£¬·“Ó¦Īļ·Ö×ÓÄŚµÄ»Æѧ¼ü¶ĻĮŃ£¬²śĪļ·Ö×ÓÄŚµÄ»Æѧ¼üŠĪ³É | |
| D£® | ¼«ŠŌ¼ü²»ŹĒŅ»ÖÖ»Æѧ¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “óĘųĪķö²ĪŪČ¾ĻÖĻóµÄ²śÉśÓėĘū³µĪ²ĘųÅÅ·ÅÓŠ¹Ų | |
| B£® | ²£Į§ŗĶµŖ»Æ¹čĢՓɶ¼ŹōÓŚŠĀŠĶĪŽ»ś·Ē½šŹō²ÄĮĻ | |
| C£® | »īŠŌĢæÓė¶žŃõ»ÆĮņ¶¼æÉÓĆÓŚĘÆ°×£¬ĘäĘÆ°×ŌĄķĻąĶ¬ | |
| D£® | æÕĘųÖŠµÄ³ōŃõ¶ŌČĖĢå½”æµÓŠŅęĪŽŗ¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
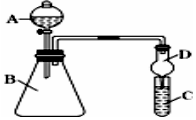 ijĶ¬Ń§ĪŖĢ½¾æŌŖĖŲÖÜĘŚ±ķÖŠŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ£¬Éč¼ĘĮĖČēĻĀĻµĮŠŹµŃ飮
ijĶ¬Ń§ĪŖĢ½¾æŌŖĖŲÖÜĘŚ±ķÖŠŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀÉ£¬Éč¼ĘĮĖČēĻĀĻµĮŠŹµŃ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ČÜŅŗÖŠCa2+ŹżÄæ¼õÉŁ | B£® | ČÜŅŗpHÖµŌö“ó | ||
| C£® | ČÜŅŗÖŠc£ØCa2+£©Ōö“ó | D£® | ČÜŅŗpHÖµ²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ź±¼ä£Ømin£© | 5 | 10 | 15 | 20 | 25 | 30 |
| Ń¹Ēæ±Č£ØPŗó/PĒ°£© | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H5OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+3H2O£Øg£©”÷H=-1 367.0 kJ•mol-1£ØČ¼ÉÕČČ£© | |
| B£® | NaOH£Øaq£©+HCl£Øaq£©ØTNaCl£Øaq£©+H2O£Øl£©”÷H=+57.3 kJ•mol-1£ØÖŠŗĶČČ£© | |
| C£® | S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H=-296.8 kJ•mol-1£Ø·“Ó¦ČČ£© | |
| D£® | C£Øs£©+$\frac{1}{2}$O2£Øg£©ØTCO£Øg£©”÷H=+110.5 kJ•mol-1£ØČ¼ÉÕČČ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| »Æѧ¼ü | H-H | C-H | C-C | C=C |
| ¼üÄÜ£ØkJ•mol-1£© | 436 | 413 | 348 | 612 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com