
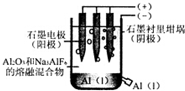
| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
分析 A、根据阳极电极反应式计算;
B、助熔剂冰晶石(Na3AIF6)可以使氧化铝在较低温度下熔融;
C、电解池中,阳极是氧离子发生失电子的氧化反应;
D、电解氯化铝溶液,阴极为氢离子得电子生成氢气,不会析出铝单质.
解答 解:A、电解池的阳极是氧离子发生失电子的氧化反应,电极反应式为:2O2-→O2↑+4e-,所以转移12 mol电子,会产生3 molO2,故A错误;
B、助熔剂冰晶石(Na3AIF6)可以使氧化铝在较低温度下熔融,所以可以降低电解的温度,故B正确;
C、电解池中,阳极是氧离子发生失电子的氧化反应,电极反应式为:2O2-→O2↑+4e-,故C错误;
D、工业制铝是电解熔融的氧化铝:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,电解氯化铝溶液,阴极为氢离子得电子生成氢气,不会析出铝单质,故D错误;
故选B.
点评 本题主要考查了铝金属的冶炼,掌握工业制铝是利用电解原理电解熔融的氧化铝:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,难度不大,注意对知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 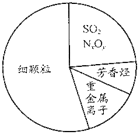 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.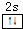 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.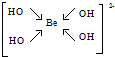 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁片镀锌时,铁片与外电源的正极相连 | |
| B. | 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和其中水的电离程度均增大 | |
| D. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com