
【题目】A、B、C、D四种化合物,其中A、B、C焰色反应均为黄色,而D的焰色反应为紫色,A、C和盐酸反应均得到B,将固体A加热分解可得到C,若在C的溶液中通入一种无色无味气体,又可得到A的溶液;若D的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式A:_____、B:_____、C:_______、D:_______、E:______
(2)按要求写出下列方程式:
①A与盐酸反应的离子方程式:__________________________;
②A固体受热分解的化学方程式:______________________;
③D溶液滴加到FeCl2溶液中出现白色沉淀及最后变成红褐色沉淀的相关化学方程式:_______________________。
【答案】NaHCO3 NaCl Na2CO3 KOH、 Fe(OH)3 HCO3-+H+== CO2 ↑+H2O 2NaHCO3![]() Na2CO3+ CO2↑+H2O 2KOH+ FeCl2=Fe(OH)2↓+2KCl、4Fe(OH)2+2H2O+O2==4Fe(OH)3
Na2CO3+ CO2↑+H2O 2KOH+ FeCl2=Fe(OH)2↓+2KCl、4Fe(OH)2+2H2O+O2==4Fe(OH)3
【解析】
A、B、C、D四种化合物,其中A、B、C焰色反应均为黄色,含有钠元素,而D的焰色反应为紫色,含有钾元素。A、C和盐酸反应均得到B,将固体A加热分解可得到C,若在C的溶液中通入一种无色无味气体,又可得到A的溶液,这说明A是碳酸氢钠,C是碳酸钠,B为氯化钠,若D的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E,所以D是KOH,E是氢氧化铁,据此答题。
(1)根据分析,A、B、C、D、E分别为NaHCO3、NaCl、Na2CO3、KOH、Fe(OH)3,故答案为:NaHCO3、NaCl、Na2CO3、KOH、Fe(OH)3。
(2)①A为NaHCO3,与盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O。
②A为NaHCO3,NaHCO3固体受热分解的化学方程式:2NaHCO3![]() Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
③D为KOH,KOH溶液滴加到FeCl2溶液中出现白色沉淀及最后变成红褐色沉淀的相关化学方程式为:2KOH+FeCl2=Fe(OH)2↓+2KCl、4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:2KOH+FeCl2=Fe(OH)2↓+2KCl、4Fe(OH)2+2H2O+O2=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】地下黑作坊用病死猪肉腌制的腊肉往往含有大量的细菌,可利用“荧光素——荧光素酶生物发光法”对市场中腊肉含细菌多少进行检测:①将腊肉研磨后离心处理,取一定量上清液放入分光光度计(测定发光强度的仪器)反应室内,加入适量的荧光素和荧光素酶,在适宜条件下进行反应;②记录发光强度并计算ATP含量;③测算出细菌数量。分析并回答下列问题:
(1)荧光素接受____提供的能量后就被激活,在荧光素酶的作用下形成氧化荧光素并且发出荧光。根据发光强度可以计算出生物组织中ATP的含量,原因是发光强度与ATP含量成____________(正比/反比);根据ATP含量进而测算出细菌数量的依据是:每个细菌细胞中ATP含量__________。
(2)“荧光素——荧光素酶生物发光法”中涉及的能量转换是_________;生物细胞中ATP的水解一般与________(吸能反应或放能反应)相联系。
(3)研究人员用不同条件处理荧光素酶后,测定酶浓度与发光强度如图所示。
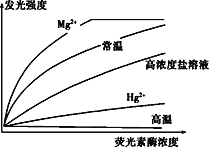
其中高浓度盐溶液经稀释后酶活性可以恢复,高温和Hg2+处理后酶活性不可恢复。若要节省荧光素酶的用量,可以使用____处理;Hg2+处理后酶活性降低可能是因为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1000mol·L-1的H3PO4溶液用0.1000mol·L-1的NaOH溶液进行滴定,其滴定曲线如下图所示[已知:滴定分数a=n(滴定液中溶质)/n(被滴定溶质)]。下列说法正确的是

A. n=1时,c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B. n=1.5时,2c(Na+)>3c(H3PO4)+3c(HPO42-)
C. n=2时,c(Na+)>c(HPO42-)>c(PO43-)>c(H2PO4-)
D. n=3时,c(OH-)=c(H+)+c(HPO42-)+c(H2PO4-)+c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为__________________________________。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d 四点中,达到平衡状态的是__________________________________。
(3)已知c点时容器中O2浓度为0.02 mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是_____________。
A.CO转化反应的平衡常数K(a)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
Ⅲ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525 mol CO2,则Y的化学式为______________。

(6)实验过程中采用NO模拟NOx,而不采用NO2的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列下列说法不正确的是 ( )
A. 铅蓄电池放电时正极的工作原理为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,其充电时阴极的反应式:PbSO4+2e-═Pb+SO42-
B. 碱性锌锰干电池放电时,负极反应式:Zn-2e-═Zn2+
C. 碱性镍氢电池放电时负极反应式:H2-2e-+2OH-═2H2O
D. 某锂离子电池的总反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,则其充电时阳极反应式为:2Li0.85NiO2-e-═2Li0.35NiO2+Li+
2Li0.85NiO2,则其充电时阳极反应式为:2Li0.85NiO2-e-═2Li0.35NiO2+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.己知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-
H++A2-
(1)某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是__________。
A.c(H+)·c(OH-)=l.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol·L-1
(2)己知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(1)该废水中加入绿矾和H+,发生反应的离子方程式为________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
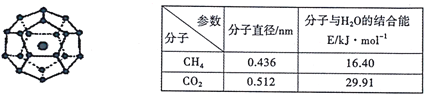
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
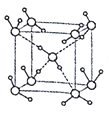
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com