
| ||

| ||
| ||


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
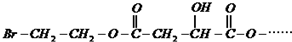 已知:X在足量的氢氧化钠水溶液中加热,可得到A、B、C三种有机物.
已知:X在足量的氢氧化钠水溶液中加热,可得到A、B、C三种有机物.
查看答案和解析>>
科目:高中化学 来源: 题型:
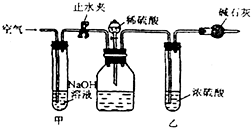
查看答案和解析>>
科目:高中化学 来源: 题型:
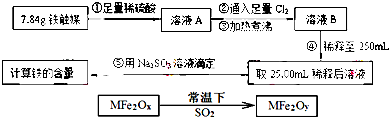
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 |
| B、FeCl3 |
| C、Fe(NO3)3 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此溶液中一定有S2-、SO32-、Na+ |
| B、此溶液中一定有S2-、Na+、NO3- |
| C、此溶液中一定无Ag+、Al3+、NO3- |
| D、此溶液中一定有S2-、Na+,至少有SO32-或NO3-中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com