
分析 W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,Z与M的最低负化合价相同,二者同主族,且Z为地壳中含量最高的元素,则Z为O元素,M为S元素,Q的原子序数最大,可推知Q为Cl;X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,X原子最外层电子数为4,X的原子序数小于氧,故X为碳元素,由(2)中Z(氧)与W形成的4核分子,则W是H元素;Y的原子序数介于C、O之间,故Y为N元素.
解答 解:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,Z与M的最低负化合价相同,二者同主族,且Z为地壳中含量最高的元素,则Z为O元素,M为S元素,Q的原子序数最大,可推知Q为Cl;X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,X原子最外层电子数为4,X的原子序数小于氧,故X为碳元素,由(2)中Z(氧)与形成的4核离子,则W是H元素;Y的原子序数介于C、O之间,故Y为N元素.
(1)Q是氯元素,处于周期表中第三周期ⅦA族,M为S元素,元素对应S2-离子的最外层电子排布式为3s23p6,
故答案为:第三周期ⅦA族;3s23p6;
(2)Z与W形成的4核分子为H2O2,结构式为H-O-O-H,Y与W也能形成某四核分子为NH3,其空间构型为三角锥形,
故答案为:H-O-O-H;三角锥形;
(3)M元素最高价氧化物对应水化物为硫酸,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意根据(2)中的问题确定W元素,需要学生具备扎实的基础,难度中等.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol/(L•s) | B. | v(A2)=0.5 mol/(L•s) | C. | v(C)=0.9 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
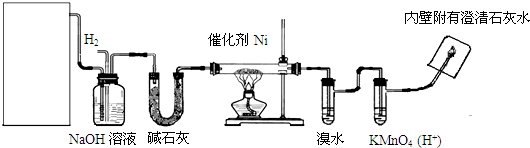
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
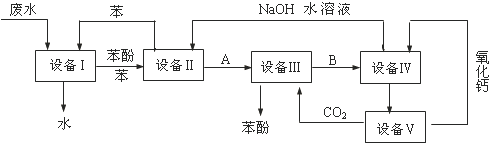
| A. | 上述流程里,设备Ⅰ、Ⅱ中进行的是分液操作;实验室里该操作可以用分液漏斗进行 | |
| B. | 上述流程里,设备Ⅲ、Ⅳ中进行的是过滤操作;实验室里该操作用到的玻璃仪器有:漏斗、烧杯、玻璃棒 | |
| C. | 在设备Ⅲ中发生反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3 | |
| D. | 图中循环使用的物质是C6H6、CaO、CO2和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
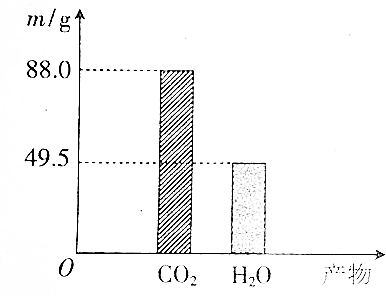
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 油漆 | C. | 石油 | D. | 煤焦油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
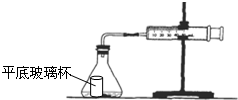 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/mL•s-1 | 0.4 | 1.0 | 1.1 | 1.3 | 0.9 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两元素可形成化合物BA2 | |
| B. | A元素位于元素周期表第二周期第VIA族 | |
| C. | A、B两元素形成的化合物能与碳反应形成单质B | |
| D. | A、B两元素形成的化合物是两性化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com