
| A. | 乙烯和乙烷 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 丙烯和丙烷 |
分析 根据混合气体的密度是相同状况下H2密度的12.5倍可以确定有机物的平均摩尔质量25g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为:$\frac{10g}{25g/mol}$=0.4mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为1.6g,物质的量为0.1mol,故烯烃的物质的量为0.3mol,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃.
解答 解:混合气体的密度是相同状况下H2密度的12.5倍,所以混合物的平均摩尔质量为12.5×2g/mol=25g•mol-1,所以混合气体中一定有甲烷,混合气体的总的物质的量为:$\frac{10g}{25g/mol}$=0.4mol,
该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为10g-8.4g=1.6g,
甲烷的物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,
故烯烃的物质的量为:0.4mol-0.1mol=0.3mol,所以M(烯烃)=$\frac{8.4g}{0.3mol}$=28g•mol-1,
设烯烃的组成为CnH2n,则:14n=28,解得:n=2,故该烯烃为乙烯,
所以该混合物为甲烷、乙烯,
故选C.
点评 本题考查混合物反应的计算、有机物分子式的确定,题目难度中等,根据平均摩尔质量确定含有甲烷是解题的关键,试题培养了学生的分析能力及化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
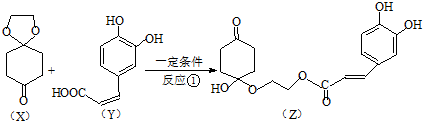
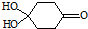 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
(已知烯醇式不稳定,会发生分子重排,例如: ).
).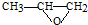 )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为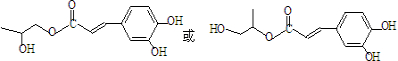 (写一种);
(写一种);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
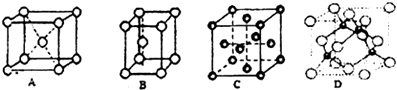
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
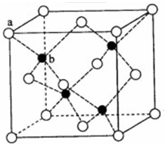 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
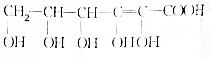 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com