
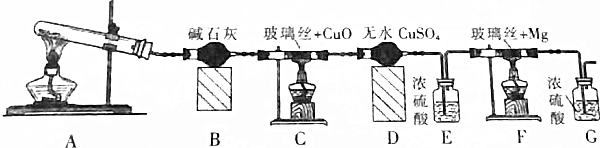
分析 装置A是利用氯化铵和氢氧化钙加热反应制备氨气,装置B为干燥氨气,氨气通入装置C和氧化铜加热反应,NH3可与CuO反应,产物之一是N2,通过装置D中的无水硫酸铜检验生成产物中的水蒸气,通过装置E中的浓硫酸吸收水蒸气,通过装置F和镁反应,氮化镁易与水反应生成Mg(OH)2与NH3.装置G是防止空气中的水蒸气进入装置F,
(1)连接装置后A处加热EG中导气管有气泡冒出,停止加热导气管中有一段水柱上升证明气密性,实验室中是利用氯化铵和氢氧化钙固体加热制备氨气,浓硫酸具有吸水性;
(2)氮化镁易与水反应生成Mg(OH)2与NH3.若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,无水硫酸铜为白色固体遇到水蒸气变化为蓝色;
解答 解:装置A是利用氯化铵和氢氧化钙加热反应制备氨气,装置B为干燥氨气,氨气通入装置C和氧化铜加热反应,NH3可与CuO反应,产物之一是N2,通过装置D中的无水硫酸铜检验生成产物中的水蒸气,通过装置E中的浓硫酸吸收水蒸气,通过装置F和镁反应,氮化镁易与水反应生成Mg(OH)2与NH3.装置G是防止空气中的水蒸气进入装置F,
(1)检查本套装置气密性的方法是:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好,实验室中是利用氯化铵和氢氧化钙固体在大试管中加热反应制备氨气,浓硫酸具有吸水性,装置E的作用是吸收水蒸气,干燥气体,
故答案为:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好; 氯化铵和氢氧化钙固体;吸收水蒸气,干燥气体;
(2)若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,氮化镁易与水也反应生成Mg(OH)2与NH3.制备得到氮化镁不纯,所以装置有三处需要加热,先加热A生成氨气充满装置后,再加热装置C,最后加热装置F,实验中应放在最后加热的是F,无水硫酸铜为白色固体遇到水蒸气变化为蓝色,证明C中反应有水生成的现象是装置D中无水硫酸铜白色变化为蓝色,
故答案为:F;防止装置F中空气未排净,镁和空气中的氧气、氮气、二氧化碳发生反应,氮化镁和水也反应,制得氮化镁不纯;装置D中无水硫酸铜白色变化为蓝色;
点评 本题考查了物质性质的实验验证、氨气制备、性质验证、反应现象、产物检验等知识点,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该有机物含碳、氢、氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳、氢原子个数之比是1:3 | |
| D. | 该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称为异戊烷 | B. | C4H9Cl有3种同分异构体 | ||
| C. | 由乙烯生成乙醇属于加成反应 | D. | 油脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8LNO与22.4LO2混合后气体的分子总数为2NA | |
| D. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒,化学性质也相同 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{37}^{17}$Cl得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同质量的烃,完全燃烧时,含氢元素质量分数越高的烃,消耗O2量越多 | |
| C. | 常温下分子中氢原子数为4的气态烃,与足量O2完全燃烧时,反应前后气体总体积不变 | |
| D. | 烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com