
| A. | 甲醛 | B. | 乙醛 | C. | 丙醛 | D. | 丁醛 |
分析 若为甲醛,则HCHO~4Ag,根据Ag的质量可以计算甲醛物质的量,再根据H原子守恒计算生成水的物质的量,与实际生成水的物质的量进行比较判断;
若不是甲醛,饱和一元醛的通式是CnH2nO,根据关系式R-CHO~2Ag计算醛的物质的量,根据H原子守恒计算醛中H原子数目,再结合组成通式可以计算醛的分子式.
解答 解:21.6g Ag的物质的量为$\frac{21.6g}{108g/mol}$=0.2mol,醛燃烧生成水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,
若为甲醛,则HCHO~4Ag,可知HCHO的物质的量为$\frac{0.2mol}{4}$=0.05mol,根据H原子守恒可知,甲醛燃烧生成水为$\frac{0.05mol×2}{2}$=0.05mol≠0.2mol,故不可能为HCHO;
设饱和一元醛的通式是CnH2nO,由R-CHO~2Ag可知,醛的物质的量为0.2mol×$\frac{1}{2}$=0.1mol,由H原子守恒可知醛中H原子数目为$\frac{0.2mol×2}{0.1mol}$=4,则分子中碳原子数目为2,则该醛为CH3CHO,
故选:B.
点评 本题考查有机物分子式确定,涉及醛的银镜反应,解题关键抓住-CHO~2Ag关系确定醛的物质的量,注意甲醛与Ag的物质的量之比为1:4,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | CuCl2固体 | C. | NaCl固体 | D. | CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
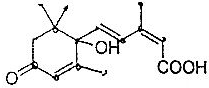 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、醛基、羧基 | |
| B. | 可以发生加成、加聚、取代、氧化等反应 | |
| C. | 含有2个手性碳原子 | |
| D. | S-诱抗素制剂的分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸性氧化物 | 一元酸 | 强电解质 | 分散系 | |
| A | Mn2O7 | 丙酸 | 三氧化二铝 | 黄河水 |
| B | NO2 | 高氯酸 | 盐酸 | 有色玻璃 |
| C | SiO2 | 石炭酸 | 氢氧化铝 | 云、雾 |
| D | SO2 | 硝酸 | 溴化氢 | 冰水混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:6:1 | B. | 8:6:1 | C. | 3:3:1 | D. | 2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
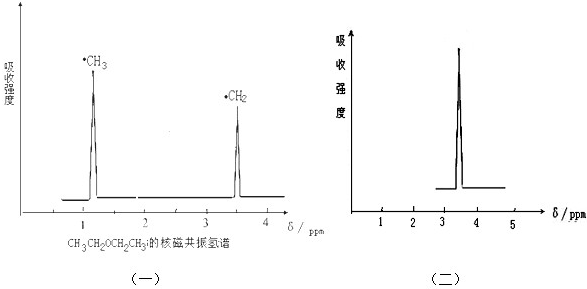
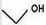 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐.碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(2007)第005号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封.避光.防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com