
简答:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72- + H2O 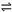 2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1) 向上述溶液中加入NaOH溶液,溶液呈_________色,因为______________________
__________________________________________________________________。
(2) 向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈_________色,因为
_____________________ 。
(3) 向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡_______ ,溶液颜色将_______________ 。
(4)已知Cr2O72-与 I- 在酸性条件下可发生氧化还原反应:
① 配平反应的离子方程式
Cr2O72--+ I-+ H+= Cr3++ I 2+ H2O
② 此反应中的氧化产物是_____,当消耗0.1 mol K2Cr2O7时,共有_________mol电子转移。
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分,用化学符号回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
| |
(1)写出下列元素的符号:①_____,⑥_____,⑦_____。
(2)在这些元素中,最活泼的金属元素是____,最活泼的非金属元素是____,最不活泼的元素是____。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,碱性最强的是_____,称为两性氢氧化物的是_________。
(4)在这些元素中,原子半径最小的是____,原子半径最大的是_____。
(5)在③与④,化学性质较活泼的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)值增大,可以采取的措施是
A.加少量烧碱溶液 B.加蒸馏水
C.加少量醋酸钠固体 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
向Cr2(SO4) 3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。其平衡关系如下:
Cr3++3OH-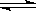 Cr(OH) 3
Cr(OH) 3 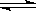 CrO2-+H++H2O
CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol/L的Cr2(SO4) 3溶液50mL中,加入1.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液为亮绿色
C.溶液中有灰绿色沉淀 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)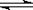 2NH3(g)
2NH3(g)
(1)若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)
为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的叙述中不正确的是( )
A.向某溶液中依次加入BaCl2溶液和稀盐酸,有不溶于稀盐酸的白色沉淀生成,则该溶液中一定含S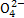
B.取醋酸钠溶液,用pH试纸检验,试纸变蓝,说明醋酸是弱酸
C.向装有碘水的分液漏斗中滴加CCl4,振荡、静置后分液,即可将碘萃取到CCl4中
D.读取滴定管内液体体积时,仰视读数,将导致读数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较中正确的是( )
A.离子的还原性:S2- >Cl- >Br- >I- B.氧化性:F2 >Cl2 >S
C.酸性:H2SO4 >HClO4 >H3PO4 D.非金属性:F >Cl >S >O
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com