
【题目】下列常见原子或基团中,不属于官能团的是( )
A. 羟基 B. 卤原子 C. 烃基 D. 乙烯基
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)![]() I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
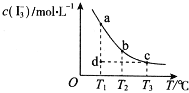
A.反应 I2(aq)+I﹣(aq)![]() I3﹣(aq)△H>0
I3﹣(aq)△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1
C.若T1时,反应进行到状态d时,一定有υ正>υ逆
D.状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应速率是描述化学反应进行快慢程度的物理量。如图是某同学利用稀硫酸和硫代硫酸钠(Na2S2O3)的反应来测定化学反应速率并探究其影响因素的实验。
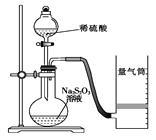
Ⅰ.测定化学反应速率:已知:S2O![]() +2H+ === H2O+S↓+SO2↑
+2H+ === H2O+S↓+SO2↑
① 除如图装置所示的实验用品外,还需要的一件实验用品是__________。
② 若在2 min时收集到224 mL(标准状况下)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是_____________________。
③ 利用该化学反应,试简述一种测定反应速率的其他方法:_______________。
Ⅱ.探究化学反应速率的影响因素:已知 I2+2S2O32- === S4O62- +2I-
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知Na2S2O3溶液足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | V | t3 |
④ 表中V =__________mL,t1、t2、t3的大小关系是____________________________。
( 2 ) 恒温条件下,在体积固定的密闭容器中,发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
请回答下列问题:
① c1+c2+c3的取值范围为____________________
② c1:c2的值为__________________ ③下列叙述能证明该反应已达到化学平衡状态的是 __________ A.混合气体密度不再变化 B.v正(X)=2 v逆(Z) C.容器内压强不再发生变化 D.混合气体的平均相对分子质量 E. X的物质的量和Y的物质的量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。有如下的A~G请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,实验测得A的pH<7,原因是(用离子方程式表示): ;在该溶液中各种离子浓度由大到小的顺序为_______________。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得B的pH>7,请分析B显碱性的原因: ____________________。
(3)C为Al2(SO4)3溶液,把C蒸干,灼烧,最后得到的固体产物是 。若把B和C混合,将产生白色沉淀和无色气体,该反应的离子方程式为__________________。
(4)D为CH3COONa溶液,常温下,pH=9的D中,水电离出来的c(OH-)=________。
(5)E为某浓度的NH4Cl溶液,常温下, 测得该溶液的pH=5,写出该溶液中下列算式的精确结果(列式):c(Cl-)-c(NH4+)=_____________ mol/L。
(6)F为Mg(OH)2溶液,求室温下F饱和溶液中Mg2+的物质的量浓度=____________ mol/L(已知室温时,Mg(OH)2的溶度积Ksp=3.2×10-11)。
(7)G为硫化钠溶液,在配制G时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式__,其单质与NaOH反应的化学方程式为__________________________________。
(2)已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子半径由大到小的顺序是________________________。(用字母表示)
(3)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
只含有极性键的是________,既有离子键又有非极性键的是_______。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
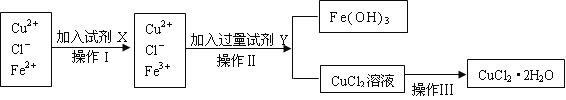
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是
A. 使用容量瓶和分液漏斗前必须检漏 B. 可以用温度计代替玻璃棒搅拌溶液
C. 进行中和滴定实验时,需用待测液润洗锥形瓶 D. 熔化氢氧化钠固体需在玻璃坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O![]() H3O++ S2-
H3O++ S2-
B.明矾加入水中起净化作用的原因:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+ Ba2++2OH-= BaCO3↓+ CO32-+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下向体积为2L的恒容密闭容器中充入6 molCO2和8mo1H2,发生反应:CO2 (g)+3 H2(g)= CH3OH(g)+H2O(g) △H=-49kJ·mol-1。测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
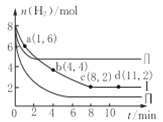
A. 该反应在O~8min内的v(CO2)=0.125mol·L-1·min-1
B. 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20%
C. 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D. 曲线II、曲线III改变条件分别是升高温度、减小压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com