
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是
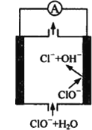
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知氢硫酸与碳酸的电离平衡常数分别为
H2S: ![]()
![]()
H2CO3: ![]()
![]()
请回答下列问题:
(1)室温下,0.1mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_________________,其原因是______________________________________________;
(2)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+nB(g) ![]() cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
A. 该反应为放热反应
B. (m+n) >(c+d)
C. 减小压强,平衡正向移动,平衡常数K值增大
D. 达到平衡后,增加A的物质的量,平衡正向移动,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
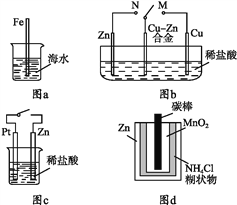
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述的化学用语中,正确的是
A. 用石墨作电极电解AlCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 在高温氧化锆的环境下,CO的燃料电池的负极反应2CO+2O2--4e-=2CO2
C. 硫化钠的水解方程式:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 电解硫酸钠水溶液的阳极反应:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.甲烷在空气中燃烧B.用光照射甲烷和氯气的混合气体
C.乙烯制备聚乙烯D.乙烯通入到溴的四氯化碳溶液,溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。
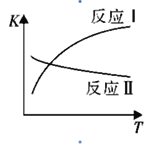
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
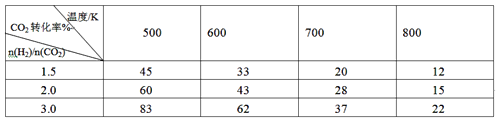
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
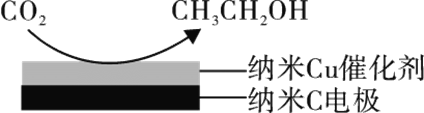
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
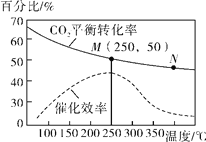
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com