
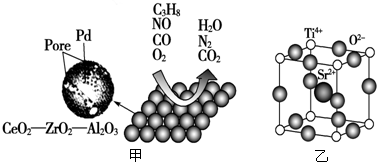
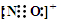
分析 (1)A.C3H8分子中,价层电子对个数=4+0=4,C原子采用sp3杂化;
B.同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;
C.根据单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键分析;
(2)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,等电子体结构相似;
(3)Ni的原子序数为28,根据能量最低原理和洪特规则书写电子排布式;配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子;
(4)Zr原子序数为40,位于周期表第5周期第ⅣB族;
(5)Sr2+在晶胞的体心,与之紧邻的O2-在晶胞的棱上,据此分析解答.
解答 解:(1)A.C3H8分子中每个C原子含有4个σ键,所以每个C原子价层电子对个数是4,则C原子采用sp3杂化,故A正确;
B.O2是以非极性键结合的双原子一定为非极性分子,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,NH3的立体构型为三角锥型,结构不对称,分子中正负电荷重心不重叠,为极性分子,故B错误;
C.1个氮氮三键中含有2个π键,故C正确;
故选AC;
(2)CO的一种等电子体为NO+,CO的结构为C≡O,则NO+的电子式为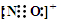 ,故答案为:
,故答案为: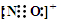 ;
;
(3)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,[Ni(CO)4]中心原子是Ni,CO提供孤电子对为配体,配位原子是为C,
故答案为:1s22s22p63s23p63d84s2;CO;C;
(4)Zr原子序数为40,价电子排布式为4d25s2,最高能层为5,位于周期表第5周期,能量最高轨道为4d,所以位于第Ⅳ副族,即元素位于周期表第5周期、ⅣB族,
故答案为:第5周期第ⅣB族;
(5)Sr2+在晶胞的体心,与之紧邻的O2-在晶胞的棱上,12条棱,每个Sr2+紧邻的O2-有12,故答案为:12.
点评 本题是对物质结构的考查,涉及杂化、分子极性、等电子体、电子式、核外电子排布、配合物、晶体结构等,掌握相关知识是解答关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
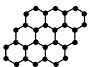 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 | |
| B. | 麻黄碱是从中药中提取的天然药物 | |
| C. | 麻黄碱能使人兴奋,运动员服用后能超水平发挥 | |
| D. | 麻黄碱有镇静催眠的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti核外电子数相等 | |
| C. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti组成的金属钛单质互称为同位素 | |
| D. | ${\;}_{22}^{48}$Ti与${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 有机物均不溶于水 | |
| C. | 甲烷在同系物中含碳量最高,是清洁能源 | |
| D. | 甲烷能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 分子晶体中的分子内不含有共价键 | ||
| C. | 分子晶体中一定有非极性共价键 | D. | 分子晶体中分子一定紧密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
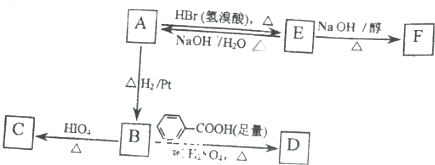
 $→_{△}^{HIO_{4}}$RCHO+R′CHO
$→_{△}^{HIO_{4}}$RCHO+R′CHO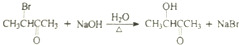 .
.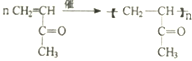 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度、压强下,1mol气态物质体积的大小由构成气体的分子大小决定 | |
| B. | 一定温度、压强下,1mol气态物质体积的大小由构成气体的分子间距决定 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 气体摩尔体积是指1 mol任何气体所占的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com