
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、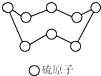 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
| 5.6g |
| 56g/mol |
| 7.8g |
| 78g/mol |
| 5.6g |
| 56g/mol |
| 32g |
| 32g/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、少量Na2SO4固体,v(H2)不变 |
| B、VmLNa2SO4溶液,v(H2)增大 |
| C、将稀硫酸改为浓硫酸,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol/L Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C、向0.2mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、快速逃离火灾现场时,应用湿毛巾捂口鼻弯腰呼吸,因为许多易燃有机高分子材料燃烧时会释放出大量有毒气体,而且热气体的密度比空气轻 |
| B、吃米饭或馒头时,多加咀嚼会感到甜味,是因为淀粉发生水解反应生成了麦芽糖 |
| C、油脂是人类的主要食物之一,“地沟油”对人体的危害极大 |
| D、肥皂的去污原理与合成洗涤剂的去污原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
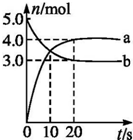 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
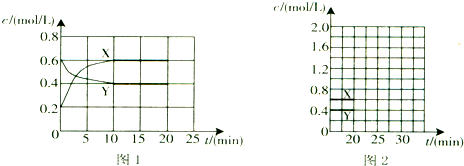
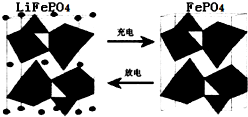
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com