
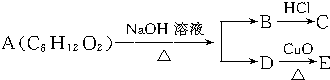
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
分析 A能发生水解反应,说明A为酯,A水解生成B、D,D能发生氧化反应,则D是醇、B是羧酸钠、C是羧酸,C、E不发生银镜反应,说明C不是甲酸、E不是醛,结合碳原子守恒判断A的结构,据此分析解答.
解答 解:A能发生水解反应,说明A为酯,A水解生成B、D,D能发生氧化反应,则D是醇、B是羧酸钠、C是羧酸,C、E不发生银镜反应,说明C不是甲酸、E不是醛,
如果C是乙酸,则D可能是2-羟基丁醇、2-甲基-2-羟基丙醇;
如果C是丙酸,则C是2-丙醇,
所以A结构简式可能是CH3COOCH(CH3)CH2CH3、CH3COOC(CH3)3、CH3CH2COOCH(CH3)2,所以有3种结构,故选B.
点评 本题考查有机物推断,侧重考查酯、醇、醛、羧酸之间的转化,知道“C、E不发生银镜反应”的含义是解本题关键,同时考查学生发散思维能力,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题

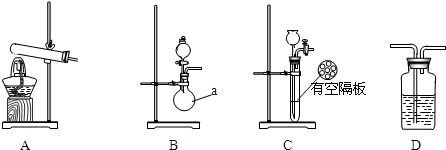
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为① (NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaSO4. |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆反应方向移动,加快氨气逸出. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论是纯水还是酸性、碱性或中性稀溶液,常温下,其c(H+)•c(OH-)=1×10-14 | |
| B. | 某溶液由水电离出的c(OH-)=10-a mol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com