
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���֪��NaClO2������Һ���¶ȵ���38��ʱ��������NaClO2��3H2O���¶ȸ���38��ʱ��������NaClO2���¶ȸ���60��ʱNaClO2�ֽ�����NaClO3��NaCl,��һ�������������¡�
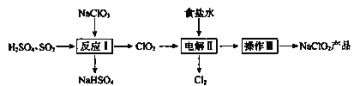
��ش��������⣺
(1)NaClO2��ClԪ�صĻ��ϼ�Ϊ____________��
(2)��ӦI��
��SO2��___________(�����������ԭ����)��
��д����ӦI�Ļ�ѧ����ʽ��__________________________��
(3)���II��
������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥ����ˮ�е�Mg2+��Ca2+����Ҫ������Լ��ֱ�Ϊ_______��______��
�ڵ������б�������������________��
�ۿ���NaOH��Һ���յ�������Cl2����Ӧ�����ӷ���ʽ��______________��
(4)����III��
��Һ����NaClO2�IJ������裺�ټ����������ڳ��ȹ��ˣ���ϴ�ӣ��ܸ���õ���Ʒ�����ȹ���Ӧ���Ƶ��¶ȷ�Χ��___________��
���𰸡�+3 ��ԭ�� 2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4 ����������Һ ̼������Һ NaCl��Cl- Cl2+2OH- =Cl-+ClO-+H2O 38��-60��
��������
�ɻ�ѧ�������̿�֪����H2SO4�ữ�����£�NaClO3��SO2����������ԭ��Ӧ����ClO2��ΪNaHSO4����Ӧ��NaClO3����������SO2�ǻ�ԭ�������װ���У�ClO2�������õ��ӷ�����ԭ��Ӧ����ClO2-��Cl-������ʧ���ӷ���������Ӧ����Cl2�� NaClO2��Һ�������ᾧ�����ȹ��ˡ�ϴ�ӡ�����õ���Ʒ��
��1��NaClO2��Na��+1�ۣ�O�ǣ�2�ۣ�����ݻ������������۴�����Ϊ0��֪Cl�Ļ��ϼ���+3�ۣ��ʴ�Ϊ��+3��
��2����H2SO4�ữ�����£�NaClO3��SO2����������ԭ��Ӧ����ClO2��ΪNaHSO4����Ӧ��NaClO3����������SO2�ǻ�ԭ������Ӧ�Ļ�ѧ����ʽΪ2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4���ʴ�Ϊ����ԭ����2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4��
��3�����������ӵ����ʣ���ȥ����ˮ�е�Mg2+��Ca2+Ӧѡ�ù�����̼������Һ��ȥ�����ӣ�ѡ������������Һ��ȥþ���ӣ��ʴ�Ϊ������������Һ��̼������Һ��
�����װ���У�ClO2�������õ��ӷ�����ԭ��Ӧ����ClO2-��Cl-������ʧ���ӷ���������Ӧ����Cl2����������б��������������Ȼ��ƣ��ʴ�Ϊ��NaCl��Cl-��
������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH����Cl��+ClO��+H2O���ʴ�Ϊ��Cl2+2OH����Cl��+ClO��+H2O��
��4���������Ϣ��֪��NaClO2������Һ���¶ȵ���38��ʱ��������NaClO2��3H2O���¶ȸ���38��ʱ��������NaClO2���¶ȸ���60��ʱNaClO2�ֽ����������ƺ��Ȼ��ƣ���˳��ȹ���Ӧ���Ƶ��¶ȷ�Χ��38����60�����ʴ�Ϊ��38����60����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3COOHΪ���������ᣬ�ڹ�ҵ�������������й㷺��Ӧ�á�
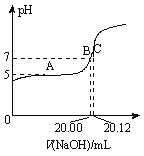
I��(1)�������к�100 mL pH��3��CH3COOH��Һ��1 L pH��4��CH3COOH��Һ����Ҫ�����ʵ���Ũ�ȵ�NaOH��Һ������ֱ�ΪV1��V2����V1_______V2(�����������������) ��
(2)�����£���0.1000 mol/L��NaOH��Һ�ζ�20.00 mLijδ֪Ũ�ȵ�CH3COOH��Һ���ζ�������ͼ��ʾ������A����ʾ��Һ��c(CH3COO��)��2c(CH3COOH)��C����ʾ��Һ�д���c(CH3COO��)+c(CH3COOH)��c(Na+)��������CH3COOH�ĵ��볣��Ka��_________��CH3COOH��Һ��ʵ��Ũ��Ϊ____________��
��1100��ʱ�����Ϊ2 L�ĺ��������з������·�Ӧ��
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)��
Na2S(s)+4H2O(g)��
(1)�������жϷ�Ӧ�ﵽƽ��״̬����________��
A��������ѹǿ����
B����������ܶȲ���
C��1 mol H-H������ͬʱ�γ�2 mol H-O
D��H2�������������
(2)��2 minʱ��Ӧ��ƽ�⣬��ʱ������������8 g������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ___________��
(3)ij�¶��¸÷�Ӧ��ƽ��״̬����û�������ƽ����Է�������Ϊ14������¶��µ�ƽ�ⳣ��KΪ_____________��
(4)�������¶ȣ�Kֵ��С����Ӧ�Ħ�H______0(���������) ��
(5)����Ӧ��ƽ�����������H2���ٴ�ƽ���H2O���������___________(���������С�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LiAlH4����Ҫ�Ĵ�����ϣ������������Na3AlF6�������Ĺ���ԭ����������������ʽ��ʾ����2LiAlH4![]() 2LiH+2Al+3H2��,��LiAlH4+2H2O��LiAlO2+4H2��������˵����ȷ����
2LiH+2Al+3H2��,��LiAlH4+2H2O��LiAlO2+4H2��������˵����ȷ����
A. ����Ӧ��������3.36L��������һ����2.7g������
B. �⻯�Ҳ��һ�ִ�����ϣ�����ԭ��ΪLiH+H2O��LiOH+H2��
C. ���ɵ���������������Ӧ�٢�ת�Ƶ�����֮��Ϊ4��3
D. LiAlH4�ǹ��ۻ����LiH�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ϳɰ���Ӧ��ij�¶���2L���ܱ������н��У��������������
N2(g)+3H2(g)![]() 2NH3(g)��H=-92.60kJ/mol
2NH3(g)��H=-92.60kJ/mol
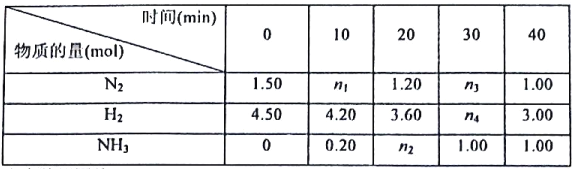
���ݱ������ݻش���
��1����Ӧ���е�20minʱ�ų�������Ϊ__________kJ��
��2��0-10min�ڵ�ƽ����Ӧ����v(N2)Ϊ__________mol/(L��min)
��3�����¶��¸��淴Ӧ�Ļ�ѧƽ�ⳣ��K(��)=__________(������λС��).
��4����Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00mol����ѧƽ�⽫__________(���������ƶ������������ƶ����������ƶ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ���й㷺��;����ش��������⣺
��1����ҵ������N2(g)+3H2(g) ![]() 2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼ��
2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼ��

�����a���ԣ�b���ܸı��������____________���жϵ�������__________________��
��a�����£�0��t0��ƽ����Ӧ����v(N2)=_____________mol��L-1��min-1��
��2����������NH3��NO2���ɵ�صķ���������ʵ����Ч��������������ŷż��ٻ�����Ⱦ�����ܳ�����û�ѧ�ܽ��д����ľ�������ͼB��ʾ��e��Ϊ������
a��ͨ��____����(�ѧʽ)���жϵ�������___________________________________��
��3��ijС����һ���º�ѹ��������9mol N2��23mol H2ģ��ϳɰ���Ӧ����ͼΪ��ͬ�¶���ƽ�������а����������������ѹǿ��p���Ĺ�ϵͼ������ϵ��T2��60MPa�´ﵽƽ�⡣
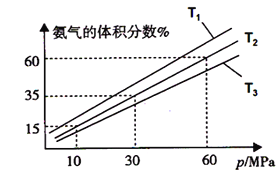
�����ж�N2(g)+3H2(g) ![]() 2NH3(g)�ﵽƽ�����______(�����) ��
2NH3(g)�ﵽƽ�����______(�����) ��
a��������ѹǿ���ٷ����仯 b�����������ܶȲ��ٷ����仯
c��v��(N2)=3v��(H2) d����������ƽ����Է����������ٷ����仯
����T1��T2��T3�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�ɴ�С������Ϊ_______________��
�۴�ʱN2��ƽ���ѹΪ__________Mpa������ѹ����ѹ�����ʵ���������
�������ʱ��ƽ�ⳣ��Kp=________������ƽ���ѹ����ƽ��Ũ�ȼ��㣬�������2λ��Ч���ֲ����ϵ�λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���ɽ��з��࣬O2����
A. ���� B. ������ C. ������ D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҽ�����������鷨�����Ƿ���˪��As2O3���ж�,�漰�ķ�Ӧ���£�
��: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(����) ��+3H2O
��: 2AsH3=2As(��ɫ�龵)+3H2
��1��д����Ļ�̬ԭ�Ӽ۵����Ų�ʽ__________
��2������Ŀռ�ṹΪ_________����������ԭ���ӻ���ʽΪ________
��3������ͬ��ͬϵ����������������±���
NH3 | PH3 | AsH3 | SbH3 | |
�۵�/�� | -77.8 | -133.5 | -116.3 | -88 |
�е�/�� | -34.5 | -87.5 | -62.4 | -18.4 |
��PH3![]() AsH3
AsH3![]() SbH3���۷е��������ߵ�ԭ����______________________��NH3���������ԭ����__________________________________.
SbH3���۷е��������ߵ�ԭ����______________________��NH3���������ԭ����__________________________________.
��4����һ����������I(As)____ I(Se)
��5������������BN�����������ĥ���������ϣ��侧���ṹ����ʯ���ƣ���ͼ��ʾ��
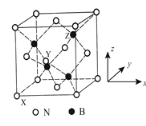
��������������Ҫ�أ�ԭ�������������ʾ�����ڲ���ԭ�ӵ����λ�á���ͼb��ʾ������ԭ���������XΪ��0��0��0����Yԭ�ӵ��������Ϊ��1/2��0��1/2������Zԭ�ӵ��������Ϊ________���������������������Ĵ�С����״����֪������������ܶ�Ϊd gcm��3�������ӵ�����ֵΪNA��������a��________nm�����г�����ʽ���ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ���Ϊս�����ʣ��г�ɫ�����ܺ㷺��Ӧ�á���ˮ�ܿ� (��Ҫ�ɷ�ΪCo2O3��CoO��CuO��Fe2O3��CaO��MgO��NiO��SiO2��)Ϊԭ���Ʊ�CoCl2��6H2O�Ĺ���������ͼ��ʾ:

�ش���������:
��.�������
��1���ܵĽ����������ʱ�䡢�¶ȵı仯��ϵ����ͼ��ʾ���ۺϿ��dzɱ���Ӧѡ�����ѹ�������Ϊ______��______������A����Ҫ�ɷ�Ϊ_______��

��2��Co2O3��Ũ���ᷴӦ����CoSO4����ѧ����ʽΪ__________________
��.���������ӡ������������
��3����������������Na2SO4���壬��������ɫ�����������Na2Fe6(SO4)4(OH)12���ӷ���ʽΪ__________________��
��4�����ơ�þ����������NaF����Mg2+ǡ����ȫ����ȥ(����Ũ�ȵ���10-5mol/L)ʱ��c(Ca2+)=__________(��λ��Ч���֣�Ksp(MgF2)=7.4��10-11��Ksp(CaF2)=1.5��10-10��
��5����ͭ����������Na2S2O3��������Ӧ2CuSO4+2Na2S2O3+2H2O=Cu2S��+S��+2Na2SO4+2H2SO4���÷�Ӧ�Ļ�ԭ����Ϊ___________
��.����ȡ�ͷ���ȡ��
��6����ˮ��C���е���Ҫ������Na2SO4��________(д��ѧʽ)��
��7��ʵ���ҳ�ȡ100gԭ��(����11.80%)������ȡʱ�õ�Ũ��Ϊ0.036mol/L��CoCl2��Һ5L��������ģ��ܵIJ���=____(����=������Ԫ������/ԭ���и�Ԫ��������100%)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com