
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)Ⅰ、将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(3)Ⅱ、利用如图装置可以验证非金属性的变化规律. 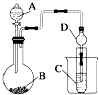
实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
(4)若要证明非金属性:S>C>Si,则A中加 , B中加Na2CO3 , C中加 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 .
【答案】
(1)2Al+6H+=2Al3++3H2↑
(2)不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物
(3)浓盐酸、KMnO4、Na2S;S2﹣+Cl2=S↓+2Cl﹣
(4)H2SO4;Na2SiO3;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣
【解析】解:I、(1)同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,同一主族,原子序数越大,金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则K与盐酸反应最剧烈、Al与盐酸反应速率最慢,离子反应为:2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而NH3H2O不是氮元素的最高价氧化物的水化物,
故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3H2O不是N元素最高价氧化物对应的水化物;II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2﹣+Cl2═S↓+2Cl﹣ , 故答案为:浓盐酸、KMnO4、Na2S;S2﹣+Cl2═S↓+2Cl﹣;(4)若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加Na2CO3 , 故A中可以加硫酸,通过硫酸和碳酸钠的反应来制取CO2 , 然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3 , 离子反应为:SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ , 产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3 , 故非金属性:C>Si.故答案为:H2SO4;Na2SiO3;SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ .
I、(1)元素的金属性越强,其单质与酸或水反应越剧烈;(2)元素的最高价氧化物的水化物的碱性越强,元素的金属性越强;II、(3)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;(4)要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明.


科目:高中化学 来源: 题型:
【题目】右图是应用电化学方法检测空气中SO2的原理示意图。下列有关说法不正确的是

A. 该装置工作时能将化学能转变为电能,并有H2SO4生成
B. 电极b表面O2发生还原反应,电极附近溶液的pH升高
C. 电极a表面的电极反应式为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
D. 气体样品应从电极a区域通入,样品中的SO2在电极a表面得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S ![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为 .
(2)写出上述反应生成物中,属于非电解质的物质的电子式 , 属于电解质的物质的电子式 .
(3)上述反应中,每生成1mol氧化产物,消耗KNO3的质量为(保留1位小数).
(4)黑火药爆炸后气体产物中有一种能造成酸雨的物质,它与酸性高锰酸钾溶液反应,能使溶液生成Mn2+而使紫红色退去.
①气体产物与酸性高锰酸钾溶液反应的离子方程式 .
②利用如图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是 ( )
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 实验室用排饱和食盐水法收集氯气
C. 反应2SO2+O2![]() 2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量的说法正确的是
A. 水的摩尔质量是18g
B. 任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
C. 2mol水的摩尔质量是1mol水摩尔质量的2倍
D. 水的摩尔质量是氢气摩尔质量的9倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)实验室里盛放碱液的试剂瓶瓶塞不能用玻璃塞,请解释原因(用化学方程式表示);
(2)在偏铝酸钠溶液中滴入盐酸至过量,现象:;离子方程式: .
(3)向100mL 0.1molL﹣1的AlCl3溶液中滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 ![]() H和
H和 ![]() H+两种粒子,下列叙述正确的是( )
H+两种粒子,下列叙述正确的是( )
A.质子数一定相同,质量数和中子数一定不同
B.化学性质几乎完全相同
C.一定都由质子、中子、电子构成
D.核电荷数,核外电子数一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。

①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
(4)实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是 (_____)
(_____)
选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合为
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | 石灰水 | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com