
| A、钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu |
| B、AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| C、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、二氧化硅溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O |


科目:高中化学 来源: 题型:
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验拟作 | 实验目的或结论 |
| A | 向某溶液中加人稀盐酸,放出无色剌激性气味气 体.将气体通人澄清石灰石灰水变混浊 | 证明该格液中存在SO 32- |
| B | 将NaOH溶液滴人该溶液中加热?放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
| C | 将Cl2,通人品红溶液中,品红溶液褪色 | 证明Cl2的还性 |
| D | 用毓酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+ 强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Zn与足量任意浓度的硫酸反应转移电子数均是2NA |
| B、在常温常压下1molC7H16中含有共价键的总数目是23NA |
| C、0.1molFeCl3完全水解生成Fe(OH)3胶体粒子数目为0.1NA |
| D、33.6L 盐酸在标准状况下所含有HCl分子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA |
| B、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] |
| C、一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| D、电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、化合物 的分子式为C13H9O4N2 的分子式为C13H9O4N2 |
| B、CH3(CH2)2CH3与CH(CH3)3具有不同数目的一氯代物 |
| C、在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
| D、石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
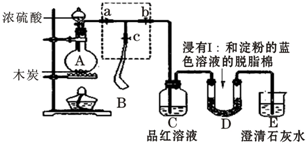
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸钠固体 | B、水 |
| C、硫酸钾溶液 | D、硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com