
 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)分析 (1)镁与醋酸反应生成醋酸镁和氢气,离子方程式中醋酸需要保留分子式;
(2)两种酸的浓度必须相等,才能比较反应速率快慢;
(3)醋酸为弱酸,溶液中只能部分电离出氢离子,则醋酸与镁的在开始时反应速率较小;由于两种酸的物质的量相等,则生成氢气的最终体积相等;
(4)该反应放热,过量镁与水反应生成了氢气;
(5)盐酸醋酸氢气速率快、醋酸慢,说明盐酸的酸性较强;
(6)根据弱电解质的电离是不完全的,酸的溶解性及酸的通性无法确定酸电离的程度,而比较酸的浓度与酸电离c(H+)可判断酸的电离程度,证明醋酸是弱电解质的常用方法有:根据醋酸的电离程度、根据醋酸的强碱盐溶液的酸碱性判断.
解答 解:(1)醋酸与镁反应生成醋酸镁和氢气,反应的离子方程式为:Mg+2CH3COOH═Mg2++2CH3COO-+H2↑,
故答案为:Mg+2CH3COOH═Mg2++2CH3COO-+H2↑;
(2)根据产生氢气的速率判断酸性强弱时,必须指出醋酸和盐酸的浓度相等,否则无法比较,所以欠缺为:没有说明两种酸的物质的量浓度相等,
故答案为:没有说明两种酸的物质的量浓度相等;
(3)醋酸为弱酸,盐酸为强酸,浓度相等时醋酸中氢离子浓度小于盐酸,则与镁的反应中,盐酸的快,醋酸的慢;由于醋酸和盐酸的浓度、体积相等,镁过量,则最终生成氢气的体积相等,
故答案为:>;=;
(4)镁在加热条件下能够与水反应,所以该反应放热,导致过量镁与水反应生成氢气,所以产生的氢气比理论值高,
故答案为:反应放热,过量镁与水反应;
(5)根据醋酸、盐酸与镁反应产生氢气的速率可知,盐酸中氢离子浓度大于醋酸,则盐酸酸性比醋酸强,
故答案为:盐酸酸性比醋酸强;
(6)①当温度低于16.6℃时醋酸可凝结成冰一样晶体,说明醋酸熔点低,不能证明其为弱酸,故①错误;
②0.1mol/L的醋酸钠溶液的pH值约为9,说明醋酸钠是强碱弱酸盐,故②正确;
③等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸是二元强酸,所以硫酸溶液消耗的氢氧化钠多,但不能说明醋酸是弱电解质,故③错误;
④0.1mol/L的醋酸的pH值约为4.8,说明醋酸部分电离,故④正确;
⑤pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多,说明醋酸部分电离,溶液中存在大量的醋酸分子,故⑤正确;
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水少,说明醋酸溶液中氢离子浓度较小,醋酸在溶液中部分电离,从而证明醋酸为弱酸,故⑥正确;
故答案为:①③.
点评 本题考查了酸性强弱比较的方法,题目难度中等,明确弱电解质的电离平衡及其影响因素为解答关键,注意掌握判断酸性强弱的方法,试题培养了学生的分析能力及化学实验能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量相同时,分子数相同 | B. | 同温同压下,密度相同 | ||
| C. | 体积相同时,分子数相同 | D. | 质量相等时,原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
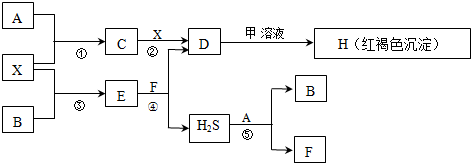
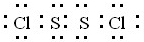 .
.| pH | 1 | 3 | 5 | 7 | 9 | 11 | 13 |
| c(S2-) | 1.4×10-19 | 1.4×10-15 | 1.4×10-11 | 6.7×10-7 | 1.9×10-5 | 1.3×10-3 | 5.7×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C4H6 1:1 | B. | CH4和C4H10 5:1 | ||
| C. | C3H4和C3H8 3:1 | D. | C2H2和C4H8 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
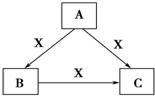 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L盐酸溶液中含H+1mol | |
| B. | 常温常压下,1mol CH4的质量为16g/mol | |
| C. | 28gC2H4和C3H6混合气体原子数目为6NA | |
| D. | 标准状况下,2.24 L H2O中所含原子数均为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com