
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是___________________________________。
(2)第④步中,相关的离子方程式是_______________________________。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_______g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须______ 。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,其结果偏高的是__________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀后,液面下降又加水 D.定容时俯视刻度线
(6)将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,此时溶液的浓度为C2 mol·L-1 ,则C1 与C2二者的关系为______。
A. C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1<C2
【答案】 取上层清液少许于试管中,滴加BaCl2 溶液,若没有沉淀生成,则说明已过量 CO32- +Ba2+ =BaCO3 ↓ CO32- +Ca2+ =CaCO3 ↓ 2.9 查漏 BD C
【解析】试题分析:由题意知,把粗盐溶于水后,加入稍过量的氯化钡溶液除硫酸根,再加入过量的氢氧化钠溶液除去粗盐中的镁离子,再加入稍过量的碳酸钠溶液除去过量的钡离子和粗盐中的钙离子,过滤后,向滤液中加入适量的盐酸除去过量的氢氧化钠和碳酸钠后,蒸发、结晶、烘干得到精盐。
(1)判断BaCl2已过量的方法是取上层清液少许于试管中,滴加BaCl2 溶液,若没有沉淀生成,则说明已过量。
(2)第④步中,加入碳酸钠溶液有两个作用,一是除去前面过量的氯化钡,二是除去粗盐中的氯化钙杂质,相关的离子方程式是CO32- +Ba2+ =BaCO3 ↓ 、 CO32- +Ca2+ =CaCO3 ↓。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,由于没有230mL的容量瓶,需选择250mL的容量瓶配制250mL溶液,并且按照250mL溶液计算出所需氢化鏰的质量为2.925,则需用托盘天平称取精盐固体的质量为2.9g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须查漏。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,A.称量时NaCl已潮解,则称量氯化钠的质量偏小,所配溶液浓度偏低; B.天平的砝码已锈蚀,则砝码质量偏大,所称量溶质质量偏大,所配溶液浓度偏高;C.定容、摇匀后,液面下降又加水,溶液体积偏大,所配溶液浓度偏低; D.定容时俯视刻度线,溶液体积偏小,所配溶液浓度偏高;其结果偏高的是BD。
(6)C1 mol·L-1NaCl溶液的密度大于水,将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,溶液的体积大于原来的2倍,即V2>2V1,此时溶液的浓度为C2 mol·L-1 ,由于稀释前后溶质的物质的量不变,则C1V1=C2V2,C1 与C2二者的关系为C1>2C2,选C。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 k J·mol1
2NO(g) ΔH=+180.5 k J·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 k J·mol1
2NO2(g) ΔH=116.5 k J·mol1
回答下列问题:
(1)CO的燃烧热为_________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)CO将NO2还原为单质的热化学方程式为_______。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.28 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=___________,此温度下,该反应的平衡常数K=________。
②能说明上述反应达到平衡状态的是_________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是___________ ,图中压强(p1,p2、p3)的大小顺序为_________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
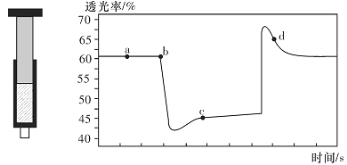
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是
A. H+、Na+、ClO-、CO32- B. K+、Ca2+、Cl-、NO3-
C. K+、Cu2+、OH-、NO3- D. H+、Na+、Fe2+、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是

A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下:
 (图中虚线表示氢键)
(图中虚线表示氢键)
下列说法不正确的是
A.聚维酮的单体是
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com