
| A. | 分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有4种 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4--二氯甲苯 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 合成顺丁橡胶( 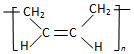 )的单体是CH3-CH=CH-CH3 )的单体是CH3-CH=CH-CH3 |
分析 A.先确定分子式为C5H11Cl的同分异构体,在此基础上进行判断;
B.甲苯与氯气在光照下反应,取代甲基的H原子;
C.苯酚、甲醛发生缩聚反应;
D.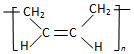 的单体为1,3-丁二烯.
的单体为1,3-丁二烯.
解答 解:A.分子式为C5H11Cl的同分异构体有:主链有5个碳原子的:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;主链有4个碳原子的:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;主链有3个碳原子的:CH3C(CH3)2CH2Cl;共有8种情况,但含有2个甲基的有机物有4种,故A正确;
B.甲苯与氯气在光照下反应,取代甲基的H原子,故B错误;
C.苯酚、甲醛发生缩聚反应,不是加聚反应,故C错误;
D.顺丁橡胶的结构简式为: ,根据加聚反应原理可得其单体为:CH2=CH-CH=CH2,故D错误.
,根据加聚反应原理可得其单体为:CH2=CH-CH=CH2,故D错误.
故选A.
点评 本题考查了高分子化合物的判断、加聚反应原理等知识,为高考常见题型,侧重考查学生的分析能力,题目难度中等,注意掌握高分子化合物的概念、常见有机反应类型.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | 常温下pH=6的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 有效碰撞一定在活化分子之间,活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| B. | SiO2具有很好的导电性,可用于制取光导纤维 | |
| C. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | 单质熔点:W>X | |
| C. | X、Y的氧化物均能与Z的氧化物对应的水化物反应 | |
| D. | X、W的最简单氢化物的水溶液均显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com