
分析 (1)发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+CO2↑+H2O,根据碳原子守恒可知n(Na2CO3•nH2O)=n(Na2CO3)=n(CO2),根据Na+守恒计算n(NaOH),进而计算NaOH 的质量分数;
(2)计算Na2CO3•nH2O的摩尔质量,进而计算n值;
(3)用NaOH溶液中和后溶质为NaCl,蒸发得到NaCl固体,根据氯离子守恒计算.
解答 解:(1)发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,
根据碳原子守恒:n(Na2CO3•nH2O)=n(Na2CO3)=n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,
根据Na+守恒,有n(NaOH)=0.1L×4mol/L-0.15mol×2=0.1mol,
所以m(NaOH)%═$\frac{0.1mol×40g/mol}{28g}$×100%=14.3%,
答:原混合物中NaOH 的质量分数为14.3%.
(2)M(Na2CO3•nH2O)=$\frac{28g-4g}{0.15mol}$=160g/mol,所以:n=$\frac{160-106}{18}$=3,
答:Na2CO3•nH2O 中的n=3.
(3)用NaOH溶液中和后溶质为NaCl,蒸发得到NaCl固体,根据氯离子守恒n(NaCl)=n(HCl)=0.05L×2mol/L=0.1mol,最终得到NaCl质量为0.1mol×58.5g/mol=5.85g,
答:最终得到固体质量为5.85g.
点评 本题考查混合物计算,难度中等,关键是用守恒法进行计算,侧重对学生思维能力与综合能力的考查.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把氯气通入到氯化亚铁溶液中 | B. | 把绿豆大的钾投入无水乙醇中 | ||
| C. | 把碘化钾溶液滴入淀粉溶液中 | D. | 把乙烯通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 | |
| C. | 铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再各加一小块(绿豆大小)吸干煤油的金属钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
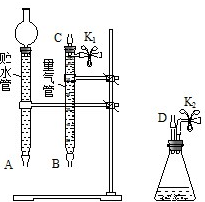 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.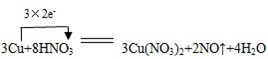 .
.| 实验编号 | 稀硝酸的浓度 /(mol/L) | 稀硝酸的体积 /mL | 温度 /℃ | 时间 /min | 收集气体的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 使体积不变,充水蒸气使体系压强增大 | |
| D. | 使压强不变,充氮气使容器体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲表示A、B 两物质的溶解度随温度变化情况,将tl℃时A、B 的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. | 乙表示常温下,稀释HA、HB 两种酸的稀溶液时,溶液pH 随加水量的变化,则NaA 溶液的pH 小于同浓度的NaB 溶液的pH | |
| C. | 丙表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 丁表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A 对应的状态为化学平衡状 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com