
【题目】现有下列物质:①NaClO溶液;②Cu;③稀硫酸;④BaSO4;⑤乙醇;⑥SiO2;⑦乙烯;⑧熔融的KCl;⑨石墨;⑩冰醋酸。回答下列问题:
(1)上述物质中属于电解质的是______。(填写序号,以下同)
(2)上述物质中可以导电的是______。
(3)写出在催化剂存在条件下⑦转化为⑤的化学方程式______。
【答案】④⑧⑩ ①②③⑧⑨ CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
【解析】
(1)在水溶液或者熔融状态下能导电的化合物属于电解质,在水溶液和熔融状态下都不导电的化合物属于非电解质;
(2)物质导电的条件是含有自由电子或者自由离子;
(3)在催化剂存在条件下⑦转化为⑤的反应是乙烯水化反应生成乙醇。
①NaClO溶液导电,既不是电解质也不是非电解质;
②Cu为金属单质,导电,既不是电解质也不是非电解质;
③稀硫酸导电,为溶液既不是电解质也不是非电解质;
④BaSO4不能导电,熔融状态导电属于电解质;
⑤乙醇不能电离属于非电解质;
⑥SiO2不能导电,不能电离属于非电解质;
⑦乙烯不能导电,不能电离属于非电解质;
⑧熔融的KCl导电,属于电解质;
⑨石墨是单质导电,既不是电解质也不是非电解质;
⑩冰醋酸不能导电,水溶液中导电属于电解质;
(1)属于电解质的是④⑧⑩;
(2)物质中可以导电的是:①②③⑧⑨;
(3)在催化剂存在条件下⑦转化为⑤的化学方程式:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】下列说法或做法正确的是( )
A.金属离子只有氧化性,非金属离子只有还原性
B.硫酸亚铁溶液中需加入还原铁粉防止亚铁离子氧化
C.用50mL量筒量取2mL蒸馏水
D.金属钠保存在盛有煤油的细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与工农业生产和人类生活密切相关。下列说法中不正确的是( )
A.明矾[KAl(SO4)2·12H2O]可用作净水剂
B.海轮外壳上镶入锌块,可减缓船体的腐蚀
C.聚氯乙烯塑料袋可用于包装食品
D.减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.NO是第一个被发现的生命体系气体信号分子,具有舒张血管的功能。工业上可用“氨催化氧化法”生产NO,主要副产物为N2。请回答下列问题:
(1)以氨气、氧气为原料,在催化剂存在下生成NO和副产物N2的热化学方程式如下:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)
4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)
2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)![]() 2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
(2)某化学研究性学习小组模拟工业合成NO的反应。在1110K时,向一恒容密闭容器内充入1mol NH3和2.8mol O2,加入合适催化剂(催化剂的体积大小可忽略不计),保持温度不变,只发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①下列各项能说明反应已达到化学平衡状态的是_______。(填字母序号)
a.5c(NH3)=4c(O2)
b.N-H键的生成速率与O-H键的生成速率相等
c.混合气体的压强不变
d.混合气体的密度不变
②若其他条件不变,将容器改为恒容的绝热容器,在达到平衡后的体系温度下的化学平衡常数为K1,则K1_____K(填“>”、“<”或“=”)。
II.(3)某化学研究性学习小组模拟用CO和H2合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_______,该温度下平衡常数K=_______。
III.(4)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为_____________。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到5.6 L(标准状况)气体时,消耗甲烷的体积为________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL2molL-1NaOH溶液中通入标准状况下6.72L二氧化碳气体,完全反应后所得溶液中:
(1)完全反应后所得溶液的溶质为______。
(2)在所得溶液中加入0.5molL-1的盐酸,至少加入______mL后才会有CO2气体放出。(不考虑CO2溶解于水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. HOCH2COOH在一定条件下可与O2、 NaHCO3溶液、乙醇、乙酸发生反应,且反应类型相同
B. C2H3COOC2H5存在C4H9COOH时可以加入饱和NaOH溶液后分液除去
C. 金刚烷(如图结构)含有属于芳香化合物的同分异构体
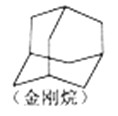
D. 与 NaHCO3溶液反应产生CO2的链状有机物C4H6O2,与HBr加成可生成5种同分异构体(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
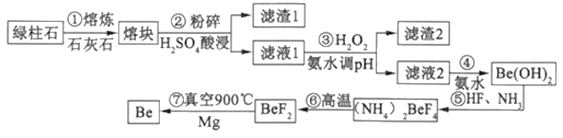
【题目】一种新兴材料——铍日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3 BeO·Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
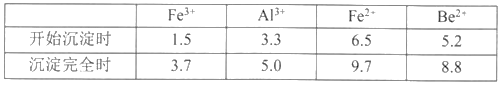
按元素周期表的对角线规则,Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:
(1)步骤②中将熔块粉碎的目的是___________;滤渣1的主要成分是___________。
(2)步骤③加入H2O2时发生反应的离子方程式为___________,从滤液1中得到沉淀的合理pH为___________(填序号)
A.3.3—3.7 B.3.7—5.0 C.5.0—5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是___________。从溶液中得到(NH4)2BeF4的实验操作是___________、过滤、洗涤、干燥。
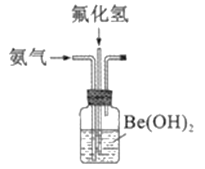
(4)实验室模拟步骤⑤装置如图,控制氨气与氟化氢气体积比的方法是_______________。
(5)步骤⑥的反应类型是___________,步骤⑦需要隔绝空气的环境,其原因是___________。
(6)若绿柱石中BeO的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金___________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.最高正化合物:P>N>C
B.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2S
D.碱性:LiOH>NaOH>KOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com