
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
分析 A.高分子化合物相对分子质量大于10000;
B.硅胶、生石灰具有吸水性,还原铁粉具有还原性;
C.氯碱工业中氯离子放电,则阳离子需要移动到阴极;
D.水煤气的主要成分氢气与一氧化碳.
解答 解:A.油脂相对分子质量较小,不是高分子化合物,故A错误;
B.食品包装袋中常有硅胶、生石灰作用防止食品受潮变质,还原铁粉,作用是防止食品氧化变质,故B错误;
C.氯碱工业中氯离子放电,则需要阳离子交换膜使阳离子移动到阴极,故C正确;
D.水煤气的主要成分氢气与一氧化碳,是无机物,不属于烃类,故D错误;
故选:C.
点评 本题考查化学在生产生活中的应用,把握电解原理、高分子化合物的概念、物质性质及应用为解答的关键,注意把握常见物质的性质和用途.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,2,7,7-四甲基辛烷的一氯取代物有4种 | |
| B. | 甲醇与分子式为C3H8O的某种有机物相差2个CH2原子团,故它们一定互为同系物 | |
| C. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| D. | 甲烷和 Cl2的反应与乙烯和 Br2的反应属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤点豆腐,明矾净水和利用电泳来分离各种氨基酸和蛋白质都与胶体的性质有关 | |
| B. | 人工制造的铝硅酸盐分子筛可用作吸附剂和催化剂载体 | |
| C. | 生物柴油可以用廉价油脂与甲醇发生酯交换反应制得,属于不可再生能源 | |
| D. | 在建的国产航母采用了新的防腐蚀技术,传统的船舶防腐蚀技术是在船体上焊接一些锌块,原理是采用牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 物质 | 甲 | 乙 | 丙 |
| A | N2 | O2 | H2 |
| B | Al | 盐酸 | Fe2O3 |
| C | SiO2 | Cl2 | NaOH(aq) |
| D | SO2 | 氨水 | NaHCO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
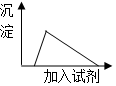
| A. | 该溶液中,Ag+、K+、NH4+、SO42-可以大量共存 | |
| B. | 该溶液中,Na+、OH-、NO3-、CO32-不能大量共存 | |
| C. | 向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 | |
| D. | 向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
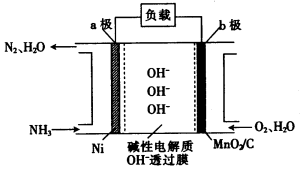
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com