
分析 标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}{V}_{m}$计算氯气体积,氯气和氢气反应方程式为Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据氯气和氢气之间关系式计算需要氢气物质的量;根据Cl原子守恒计算生成n(HCl),由c=$\frac{n}{V}$计算盐酸浓度.
解答 解:标况下,气体摩尔体积是22.4L/mol,(Cl2)=$\frac{35.5g}{71g/mol}$=0.5mol,
V(Cl2)=nVm=$\frac{m}{M}{V}_{m}$=$\frac{35.5g}{71g/mol}$×22.4L/mol=11.2L,氯气和氢气反应方程式为Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据氯气和氢气之间关系式得需要n(H2)=n(Cl2)=0.5mol;根据Cl原子守恒计算生成n(HCl)=2n(Cl2)=1mol,c(HCl)=$\frac{n}{V}$=$\frac{1mol}{1L}$=1mol/L,
故答案为:11.2;0.5;1.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量关系是解本题关键,熟练掌握物质的量基本公式并灵活运用,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
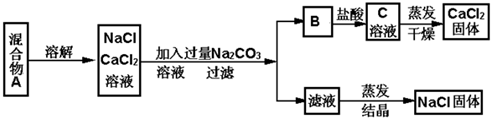
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用于制造光纤制品 | B. | 碳酸氢钠常用于焙制糕点 | ||
| C. | 氧化铝可用于制造耐火坩埚 | D. | 氢氧化铝常用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少 | |
| B. | 用洁净铁丝蘸取两种样品在酒精灯火焰上灼烧,火焰颜色呈黄色的是小苏打 | |
| C. | 分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 | |
| D. | 先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

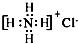
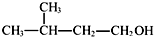
| A. | ①②③ | B. | ③④ | C. | ②④⑤ | D. | ①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com