
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 浓硫酸具有强氧化性,常温下可将铝的单质氧化,因此,不能用铝罐车运输浓硫酸 | |
| C. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| D. | 浓盐酸与足量二氧化锰反应后,盐酸有剩余 |
分析 A、随反应的进行浓硝酸变成稀硝酸;
B、浓硫酸具有强氧化性,铁与铝与浓硫酸发生钝化现象;
C、加入NaHCO3,氯气和水的平衡正向移动,次氯酸根离子浓度变大,氧化性增强;
D、二氧化锰与稀盐酸不反应.
解答 解:A、随反应的进行浓硝酸变成稀硝酸,浓的硝酸与铜反应生成二氧化氮,稀硝酸生成一氧化氮,故A正确;
B、浓硫酸具有强氧化性,铁与铝与浓硫酸发生钝化现象,所以常温下可以用铝罐车运输浓硫酸,故B错误;
C、加入NaHCO3,氯气和水的平衡正向移动,次氯酸根离子浓度变大,氧化性增强,故C错误;
D、二氧化锰与稀盐酸不反应,随反应的进行浓盐酸变稀盐酸,所以盐酸有剩余,故D正确;
故选BC.
点评 本题考查硝酸、硫酸和盐酸的性质,综合性强,有一定的难度,学生要清楚稀盐酸与二氧化锰不发生氧化还原反应.


科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | NaOH溶液与NH4Cl溶液共热:OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Cl2与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | FeCl3溶液刻蚀铜电路板:Fe3++Cu═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
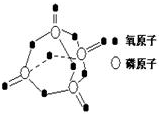 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
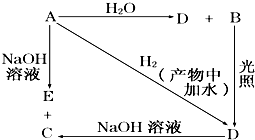
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

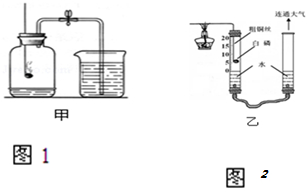
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
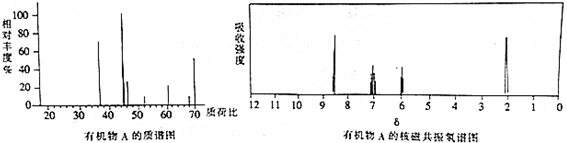
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L MgCl2溶液中含Cl-数为0.1NA | |
| B. | 1mol Na完全转化为Na2O2时,失去的电子数目为2NA | |
| C. | 含有NA个氢原子的氢气的体积约为11.2L | |
| D. | 1.8g NH4+中所含电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com