
(8分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe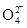 )。
)。
Ⅱ.SCN-的电子式为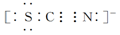
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe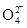 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
(8分)(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2Fe +6Cl-+16H+
+6Cl-+16H+
②SCN-被Cl2氧化 (方程式2分,其余每空1分)
【解析】(1)由于生成的氢氧化亚铁极易被空气氧化生成氢氧化铁,所以实验现象是首先产生白色沉淀,然后迅速变为灰绿色,最终变成红褐色。有关反应的方程式是FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(2)①在反应铁元素的化合价从+3价升高到+6价,失去3个电子,而氯气只能得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe3++3Cl2+8H2O===2Fe +6Cl-+16H+。
+6Cl-+16H+。
②根据SCN-的电子式可知,S和N元素的化合价分别是-2价和-3价,易被氯气氧化,因此红色也可以褪去。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
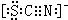 .
.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 .
.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
【实验目的】测定食醋的总酸量
【实验原理】中和滴定
【实验用品】蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),
0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
【实验步骤】
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
【数据记录】
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
【问题与思考】
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com