
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是________________;(填编号)
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_____;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是__________________,

稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”),理由是:__________________;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________。(填准确数值)
30.(1) a>b>d>c (2) A (3) 大于 HX稀释时,PH变化大些 大于 PH大的HX中C(H+)低,对水的电离抑制不如酸性较强的醋酸; (4)9.9×10-7mol/L
【解析】
试题分析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>HCO3—,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a,b,d,c;(2)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH,CH3COO-,H+浓度却都要减小,但c(OH-)却是增大的,且CH3COOH浓度减少最多,因此A项正确;(3)稀释相同倍数,HX溶液的pH变化比CH3COOH溶液的大,酸性强,电离平衡常数大,HX的电离常数大于CH3COOH的电离常数;HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol·L-1-10-8 mol·L-1=9.9×10-7 mol·L-1。
考点:考查PH值的大小判断,弱电解质的电离等知识。


科目:高中化学 来源:2015届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
溶液中,下列电离方程式正确的是
A.KAl (SO4)2=K++Al3++2 SO
B.H2CO3=H++HCO
C.Ca(HCO3)2=Ca2++2H++2CO
D.Ba(OH)2=Ba2++OH2-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
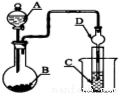
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是

A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+ 6H+ = 2Mn2+ + 5NO3- + 3H2O
B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH- = CO32-+ NH3?H2O +H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- = 2Fe 2+ + I2
D.用惰性电极电解熔融氯化钠:2Cl-+2H2O = Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
臭氧是重要的氧化剂和水处理剂。已知:2O3(g)  3O2(g) △H=-144.8kJ/mol,t℃时,K=3×1076,下列说法错误的是
3O2(g) △H=-144.8kJ/mol,t℃时,K=3×1076,下列说法错误的是
A.O3转化为O2在任何温度下均能自发进行
B.t℃时3O2(g)  2O3(g) K=3.33×10-77
2O3(g) K=3.33×10-77
C.通电时,O2转化为O3,此过程电能转化为化学能
D.1molC在O2中或O3中完全燃烧生成1molCO2放出热量相等
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是
A、200mL0.5mol/LNaCl溶液 B、100mL1mol/LNa2CO3溶液
C、100mL0.5mol/LNa3PO4溶液 D、1L1mol/LNaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:填空题
(12分) 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
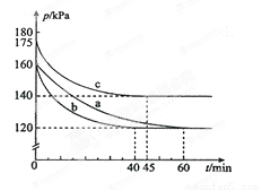
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX3)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由小到大的次序为 (填实验序号);
③与实验a相比,其他两组改变的实验条件及判断依据是:
b ;
c. 。
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com