
【题目】根据题意解答
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是 , 负极的电极反应式是 .
(2)如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒. 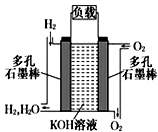
根据所学知识试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式: .
②如果该氢氧燃料电池每转移1mol电子,消耗标准状况下氧气的体积为 .
③阳离子向极移动(填写正或负),反应一段时间后整个溶液的碱性(填增强,减弱或者不变).
④若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
【答案】
(1)铜;Cu﹣2e﹣═Cu2+
(2)O2+2H2O+4e﹣=4OH﹣;5.6L;正;减弱;CH4+10OH﹣﹣8e=CO32﹣+7H2O
【解析】解:(1)铜、银与硝酸银设计的原电池,负极为铜,被氧化发生氧化反应,电极方程式为:Cu﹣2e﹣═Cu2+ , 所以答案是:铜;Cu﹣2e﹣═Cu2+;(2)①氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e﹣═4OH﹣; 所以答案是:2H2O+O2+4e﹣═4OH﹣;②已知2H2O+O2+4e﹣═4OH﹣ , 则每转移1mol电子消耗的氧气为: ![]() ×1mol=0.25mol,所以V(O2)=nVm=0.25mol×22.4L/mol=5.6L;
×1mol=0.25mol,所以V(O2)=nVm=0.25mol×22.4L/mol=5.6L;
所以答案是:5.6L;③原电池中阳离子移向正极;燃料电池的总反应为2H2+O2=2H2O,反应后溶液体积增大,溶液的碱性减弱;
所以答案是:正;减弱;④燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.放电时正极反应为:FeO ![]() +4H2O+3e﹣═Fe(OH)3+5OH﹣
+4H2O+3e﹣═Fe(OH)3+5OH﹣
C.放电时正极附近溶液的碱性增强
D.放电时每转移3mol电子,正极有1molK2FeO4被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题. 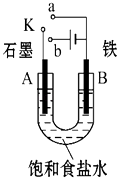
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 总反应的离子方程式为 .
(3)若开关K与b连接,下列说法正确的是(填序号) .
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一个化学过程的示意图. 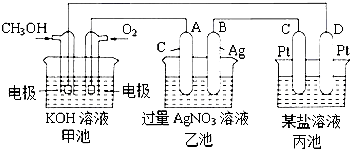
(1)图中乙池是装置.
(2)C(Pt)电极的名称是 .
(3)写出通入CH3OH的电极的电极反应式是 .
(4)乙池中反应的离子方程式为 .
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是
A.MgSO4 B.CuSO4 C.NaCl D.CuCl2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4H2O含有的结晶水分子数为0.02NA(2CaSO4H2O式量为290);
⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA .
A.①②③④⑤⑦
B.②③⑤⑥
C.①③④⑤⑥
D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L
B.V L Fe2(SO4)3溶液中含a g SO42﹣ , 取此溶液 ![]() ?L用水稀释成2V L,则稀释后溶液的c(Fe3+)为
?L用水稀释成2V L,则稀释后溶液的c(Fe3+)为 ![]() ?mol/L
?mol/L
C.已知某NaCl溶液的密度是1.17 g/cm3 , 可求出此溶液的物质的量浓度
D.把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判断NaOH混合溶液的质量分数等于15%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.2mol
B.3mol
C.4mol
D.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com