
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2?Fe(SO2)63+(反应b) | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
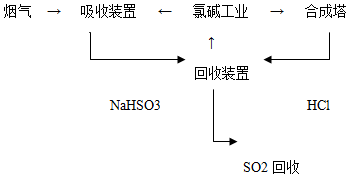
分析 (1)①氯碱工业产品之一为NaOH,用NaOH吸收SO2;
②已知每合成1mol HCl放出热量92.3kJ,故其热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1;
③回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液
(2)①利用FeCl3溶液的氧化性吸收烟气中的SO2,SO2在溶液中被氧化为SO42-,同时Fe3+被还原为Fe2+;故方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
②丁达尔效应是检验胶体的常用方法;
③Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动.
解答 解:(1)①氯碱工业产品之一为NaOH,用NaOH吸收SO2,其离子方程式为:SO2+OH-=HSO3-,
故答案为:SO2+OH-=HSO3-;
②已知每合成1mol HCl放出热量92.3kJ,故其热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1;
③回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液,故答案为:NaCl溶液;
(2)①利用FeCl3溶液的氧化性吸收烟气中的SO2,SO2在溶液中被氧化为SO42-,同时Fe3+被还原为Fe2+,故答案为为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②丁达尔效应是检验胶体的常用方法,故答案为:丁达尔效应;
③Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动,故答案为:Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动.
点评 本题以SO2的性质为知识背景,综合考查了氧化还原反应、热化学方程式、胶体、平衡移动等,涉及知识点较多.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
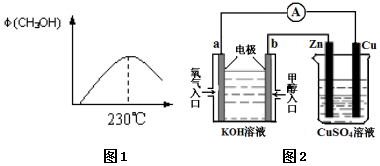 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化反应 | B. | 取代反应 | C. | 加成反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
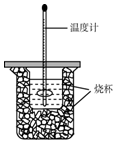 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com