
分析 n(NaOH)=$\frac{40g×60%}{40g/mol}$=0.6mol,n(NaClO)=$\frac{7.45g}{74.5g/mol}$=0.1mol,根据Na原子守恒得n(NaOH)=n(NaCl)+n(NaClO),则n(NaCl)=n(NaOH)-n(NaClO)=0.6mol-0.1mol=0.5mol,氯气、HCl分别和NaOH反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O,
(1)根据方程式知,燃烧后剩余的n(Cl2)=n(NaClO);
(2)根据方程式知,生成的n(HCl)=n(NaCl)(总)-n(NaClO)=0.5mol-0.1mol=0.4mol,根据H原子守恒得n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.4mol=0.2mol,根据Cl原子守恒得n(Cl2)=$\frac{1}{2}$[n(NaCl)+n(NaClO)]=$\frac{1}{2}$[0.5mol+0.1mol]=0.3mol,根据m=nM计算氢气和氯气的质量之比.
解答 解:n(NaOH)=$\frac{40g×60%}{40g/mol}$=0.6mol,n(NaClO)=$\frac{7.45g}{74.5g/mol}$=0.1mol,根据Na原子守恒得n(NaOH)=n(NaCl)+n(NaClO),则n(NaCl)=n(NaOH)-n(NaClO)=0.6mol-0.1mol=0.5mol,氯气、HCl分别和NaOH反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O,
(1)根据方程式知,燃烧后剩余的n(Cl2)=n(NaClO)=0.1mol,
答:燃烧后剩余氯气的物质的量是0.1mol;
(2)根据方程式知,生成的n(HCl)=n(NaCl)(总)-n(NaClO)=0.5mol-0.1mol=0.4mol,根据H原子守恒得n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.4mol=0.2mol,根据Cl原子守恒得n(Cl2)=$\frac{1}{2}$[n(NaCl)+n(NaClO)]=$\frac{1}{2}$[0.5mol+0.1mol]=0.3mol,氢气的质量=0.2mol×2g/mol=0.4g,氯气的质量=0.3mol×71g/mol=21.3g,
原来氢气和氯气的质量比=0.4g:21.3g=4:213,
答:原来氢气和氯气的质量比为4:213.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,正确书写方程式及明确各个物理量的关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把SiO2加入到NaOH溶液中:SiO2+2OH-═SiO32-+H2O | |
| B. | 向NaHCO3溶液中滴入NaOH溶液:HCO3-+OH-═CO2↑+H2O | |
| C. | 向Al(OH)3中滴入H2SO4溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 向Na2CO3溶液中滴入AgNO3溶液:2Ag++CO32-═Ag2CO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| D. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
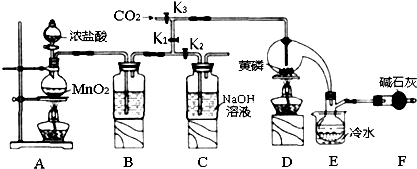
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 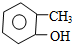 邻甲基苯酚 邻甲基苯酚 | |
| D. | 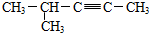 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com