

分析 由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,据此解答.
解答 解:由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2.
(1)由上述分析可知,A为Na,B为Cl2,故答案为:Na;Cl2;
(2)C+D→NaCl的化学反应为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl,
E+F→NaCl的化学反应为Na2CO3+CaCl2═CaCO3↓+2NaCl,
故答案为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)将钠投入到硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,反应的方程式为:2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,现象为:钠熔化呈小球,四处游动,有气体与蓝色沉淀生成,
故答案为:钠熔化成小球,四处游动,有气体与蓝色沉淀生成;2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(4)常用B和C反应制取“84”消毒液,该反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查无机物的推断,掌握钠及其化合物的性质、氯气的性质是解答本题的关键,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:填空题
 (1)某学生课外活动小组利用图1所示装置分别做如下实验:
(1)某学生课外活动小组利用图1所示装置分别做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+O2(g)═2NO(g);△H=+182.6kJ•mol-1 | |
| B. | H2O(g)═H2O(l);△H=-44.0kJ•mol-1 | |
| C. | 形成化学键过程中放出256.6kJ能量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
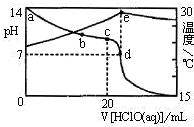 NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺. HClO+OH-.
HClO+OH-.| 温度/℃ | 20 | 30 | 40 | 80 |
| 时间/min | 10 | 10 | 10 | 10 |
| 杀菌率 | 83% | 90% | 97% | 92% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、S2-、CO32- | B. | MnO4-、SO42-、NO3- | ||
| C. | Cl-、NO3-、SO42- | D. | AlO2-、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.44 g | B. | 1.60 g | C. | 2.14 g | D. | 1.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com