
| A. | Na2S2O3溶液与H2SO4溶液混合:S2O32-+4H+═SO42-+S↓+2H2O | |
| B. | 硝酸银溶液中滴入少量氨水:Ag++2NH2•H2O═[Ag(NH3)2]++2H2O | |
| C. | AgI悬浊液中滴入适量Na2S溶液:2AgI+S2-═Ag2S+2I- | |
| D. | Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe3++3OH-═Fe(OH)3↓ |
分析 A.二者反应生成硫单质和二氧化硫、水和硫酸钠;
B.氨水过量,银离子反应生成了[Ag(NH3)2]+,氨水少量,生成氢氧化银沉淀;
C.AgI悬浊液中滴加Na2S饱和溶液时,因为Ag2S比AgI更难溶,发生沉淀的转化;
D.Fe(SCN)3为络合物,应写化学式.
解答 解:A.Na2S2O3溶液与稀硫酸发生反应生成S、二氧化硫、硫酸钠和水,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故A错误;
B.氨水过量,反应的离子方程式为:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O,氨水少量,生成氢氧化银沉淀,反应的离子方程式为:Ag++NH3•H2O=AgOH↓+NH4+,故B错误;
C.往AgI悬浊液中滴加Na2S饱和溶液时,因为Ag2S比AgI更难溶,发生沉淀的转化的离子反应为2AgI(s)+S2-(aq)=Ag2S(s)+2I-(aq),即2AgI+S2-═Ag2S+2I-,故C正确;
D.Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe(SCN)3+3OH-═Fe(OH)3↓+3SCN-,故D错误;
故选C.
点评 本题考查离子方程式的书写,明确在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:推断题
| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3受热易分解,可用作氮肥 | |
| B. | Na2CO3具有碱性,可用作胃酸中和剂 | |
| C. | SiO2易传导光信号,可用作光导纤维 | |
| D. | Ca(ClO)2在空气中不稳定,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 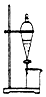 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
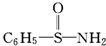 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2都是酸性氧化物,分别能形成硫酸型酸雨和硝酸型酸雨 | |
| B. | 明矾[KAl(SO4)2•l2H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| C. | 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点 | |
| D. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )
20℃时,在 c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4、NaOH 混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示.下列说法正确的是( )| A. | 0.100 mol•L-1的NaHC2O4溶液中:c(OH-)═c(H+)-2c(C2O42-)+c(H2C2O4) | |
| B. | Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| C. | P点:c(Na+)+c(H2C2O4)<0.100 mol•L-1+c(HC2O4-) | |
| D. | 该温度下H2C2O4的电离平衡常数Ka2=1×10-42mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com