
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
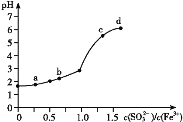
实验发现:
ⅰ.a点溶液澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ⅱ.c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。
下列分析合理的是
A.向a点溶液中滴加BaCl2溶液,无明显现象
B.b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c点溶液中发生的主要反应:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
【答案】C
【解析】
根据i的现象,a点溶液为澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,该沉淀中含有Fe(OH)2,即a点溶液中含有Fe2+,FeCl3溶液中加入Na2SO3溶液,先发生2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,c点和d点溶液中Fe3+和SO32-发生双水解反应产生红褐色沉淀,且生成H2SO3,因此无气体产生,然后据此分析;
根据i的现象,a点溶液为澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,该沉淀中含有Fe(OH)2,即a点溶液中含有Fe2+,FeCl3溶液中加入Na2SO3溶液,先发生2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,c点和d点溶液中Fe3+和SO32-发生双水解反应产生红褐色沉淀,且生成H2SO3,因此无气体产生,取上层清液滴加NaOH溶液,无明显现象,是因为NaOH与H2SO3反应,滴加KSCN溶液显红色,说明溶液中含有Fe3+,
A、a点处溶液中含有SO42-,加入BaCl2,会产生BaSO4白色沉淀,故A错误;
B、pH升高说明溶液c(H+)减小,原因是c(SO32-)增大,水解程度增大,按照给出方程式,生成H+,溶液c(H+)增大,溶液的pH应减小,不会增大,故B错误;
C、c点溶液中Fe3+和SO32-发生双水解反应,离子方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3,故C正确;
D、溶液变红后滴加NaOH会消耗溶液中的Fe3+,因此红色应变浅,故D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g), 某同学为了探究氮气和氢气反应生成氨气,在一恒温、恒容密闭容器中充入1 mol N2和3 mol H2混合发生下列反应,其中断裂1mol H2需要吸收436 kJ的能量,断裂1 mol N2需要吸收945 kJ的能量,断裂1 mol N-H键吸收391 kJ的能量。
2NH3(g), 某同学为了探究氮气和氢气反应生成氨气,在一恒温、恒容密闭容器中充入1 mol N2和3 mol H2混合发生下列反应,其中断裂1mol H2需要吸收436 kJ的能量,断裂1 mol N2需要吸收945 kJ的能量,断裂1 mol N-H键吸收391 kJ的能量。
(1)写出NH3的电子式___________________。
(2)该反应________(填“吸收”或“放出”)热量______________。
(3)当反应达到平衡时,N2和H2的转化率之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是

A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
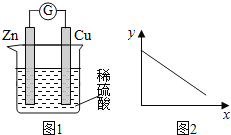
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请回答下列问题:
(1)写出A元素的最高价氧化物的电子式_____________。
(2)B元素在周期表中的位置为_____________。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______________。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2∶1的化合物,用电子式表示该化合物的形成过程______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷胺是最早用于抑制流感病毒的抗疾病毒药,其合成路线如图所示。下列说法不正确的是( )
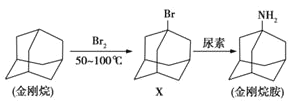
A. 金刚烷的分子式是C10H16B. X的一种同分异构体是芳香族化合物
C. 上述反应都属于取代反应D. 金刚烷的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为 2MnO2+Zn+2H2O===2MnOOH+Zn(OH)2,其构造如图所示。有关说法不正确的是( )

A.负极反应式:Zn+2OH--2e-===Zn(OH)2
B.放电时正极MnO2得到电子,发生氧化反应
C.该电池使用一段时间后,电解液pH增大
D.放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com