
分析 (1)要判断哪一种解释正确,可加入一种含有CH3COO-但溶液不显碱性的盐;
(2)如乙正确,从电离平衡移动的角度分析;
(3)将0.010molCH3COONa和0.004molHCl溶于水,由于发生CH3COO-+H+?CH3COOH,溶液中存在CH3COO-、Cl-、OH-、H+、Na+、CH3COOH和H2O等粒子,结合物料守恒和电荷守恒判断.
解答 解:(1)CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol•L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明,
故答案为:B;
(2)如乙正确,醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,则溶液pH增大,
故答案为:乙;增大;
(3)①将0.010molCH3COONa和0.004molHCl溶于水,由于发生CH3COO-+H+?CH3COOH,溶液中存在CH3COO-、Cl-、OH-、H+、
Na+、CH3COOH和H2O等粒子,共7种,故答案为:7;
②根据物料守恒可知,0.010mol CH3COONa在溶液中以CH3COOH和CH3COO-存在,n(CH3COOH)+n(CH3COO-)=0.010mol,
故答案为:CH3COOH;CH3COO-;
③溶液遵循电荷守恒,存在:n(H+)+n(Na+)=n(Cl-)+n(CH3COO-)+n(OH-),则n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,
故答案为:0.006.
点评 本题考查弱电解质的电离和盐类水解原理,题目难度不大,注意醋酸溶液中加入醋酸钠,由于醋酸钠是强电解质、在水中全部电离成Na+和CH3COO-,溶液中CH3COO-浓度增大,大量的CH3COO-同H+结合成醋酸分子,使醋酸的电离平衡向左移动,这个称为同离子效应:弱电解质溶液中加入跟该电解质有相同离子的强电解质,可以降低弱电解质的电离度.原理是:加入相同离子后,使原电解质的电离平衡向生成原电解质分子的方向移动,从而降低原电解质的电离度.


科目:高中化学 来源: 题型:填空题

 -R、-R′为可能相同或可能不同的原子或原子团
-R、-R′为可能相同或可能不同的原子或原子团 ,X中核磁共振氢谱峰面积比是2:1.
,X中核磁共振氢谱峰面积比是2:1. ,反应类型是加聚反应.
,反应类型是加聚反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
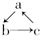 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Na | Na2O2 | NaCl |
| 2 | NaOH | NaHCO3 | Na2CO3 |
| 3 | Al2O3 | NaAlO2 | Al(OH)3 |
| 4 | AlCl3 | Al(OH)3 | NaAlO2 |
| 5 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 6 | MgCl2 | Mg(OH)2 | MgO |
| 7 | CuO | CuSO4 | Cu(OH)2 |
| 8 | Si | SiO2 | H2SiO3 |
| 9 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )| A. | 该反应的化学方程式为3A+B?2C | |
| B. | 在t1~(t110)s时,v(A)=v(B)=0 | |
| C. | t1 s时反应物A转化率为60% | |
| D. | 0~t1 s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
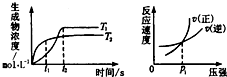 可逆反应aA(g)+bB(g)?cC(g)+dD(g);△H同时符合下列两图中各曲线的规律的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g);△H同时符合下列两图中各曲线的规律的是( )| A. | a+b>c+d T1<T2△H<0 | B. | a+b>c+d T1<T2△H>0 | ||
| C. | a+b<c+d T1>T2△H<0 | D. | a+b>c+d T1>T2△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:
如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸密闭存放于玻璃瓶中 | |
| B. | 硅主要以氧化物和硅酸盐形式存在于自然界中 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 钢是用量最大、用途最广泛的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
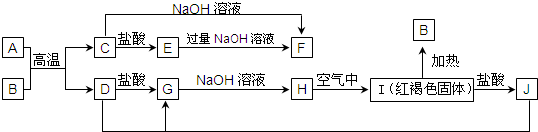
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com