
| A、两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol?L-1 |
| B、分别加水稀释100倍后,两种溶液的pH仍相等 |
| C、中和同体积的这两种酸溶液所需要NaOH物质的量也相等 |
| D、分别加入足量锌片,两种溶液生成H2的体积相等 |
| Kw |
| 10-pH |
| 10-14 |
| 10-3 |


科目:高中化学 来源: 题型:
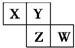 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )| A、元素Y和元素Z的氢化物中均只存在极性共价键 |
| B、单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C、元素W的最高价氧化物对应水化物的酸性最强 |
| D、元素Y和元素Z的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 5 |
| A、H2与H3互为同位素 | ||
B、N
| ||
| C、C60的硬度比金刚石大 | ||
| D、O2与O4互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2g重水(D2O,D为
| ||
| B、0.1mol F-中含有的电子数 | ||
| C、标准状况下11.2L N2和NO混合气体中的原子数 | ||
| D、1L 1mol/L Na2SO4溶液中Na+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol CO2 的体积为22.4L |
| B、CO2的摩尔质量为44g |
| C、64g SO2含有氧原子数2NA |
| D、NA个CO2的质量(g)与CO2的相对分子质量数值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
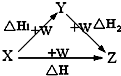 X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )| A、①②③④ | B、①③ |
| C、②④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| B、煤燃烧是热能转化为化学能的过程 |
| C、动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com