
分析 (1)①根据n=$\frac{m}{M}$计算气体的物质的量;
②根据N=nNA计算分子数目,原子数目为分子2倍;
(2)①元素化合价降低发生还原反应,所含元素化合价升高的反应物为还原剂;
②根据n=$\frac{N}{{N}_{A}}$计算电子物质的量,根据电子转移守恒计算NO的物质的量,再根据V=nVm计算NO的体积.
解答 解:(1)①气体A2的摩尔质量为Mg/mol,mg气体A2的物质的量=$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$;
②该气体所含原子总数为:$\frac{m}{M}$mol×NAmol-1×2=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(2)①反应在N元素化合价降低,发生还原反应,Cu元素化合价升高,Cu为还原剂,
故答案为:N;Cu;
②转移电子物质的量为$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,根据电子转移守恒,则生成NO的物质的量为$\frac{1.5mol}{5-2}$=0.5mol,标况下NO的体积为0.5mol×22.4L/mol=11.2L,
故答案为:11.2L.
点评 本题考查物质的量有关计算、氧化还原反应,难度不大,有利于基础知识的巩固.


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
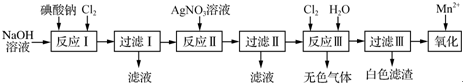
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI | B. | H2O、H2S、H2Se、H2Te | ||
| C. | NH3、PH3、AsH3、SbH3 | D. | CH4、SiH4、GeH4、SnH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
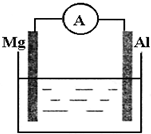 如图所示装置
如图所示装置 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | NaOH与HCl反应 | D. | 食物的缓慢氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com