
 .
.分析 (1)NaClO是离子化合物,由Na+离子和ClO-离子构成;
(2)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
(3)次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,因二氧化硫少量,所以有次氯酸生成.
解答 解:(1)NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为 ,
,
故答案为: ;
;
(2)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,
故答案为:ClO-+CO2+H2O═HClO+HCO3-;
(3)次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,因二氧化硫少量,所以有次氯酸生成,离子方程式为3ClO-+SO2+H2O=Cl-+SO42-+2HClO,
故答案为:3ClO-+SO2+H2O=Cl-+SO42-+2HClO.
点评 本题考查电子式、离子方程式的书写等知识点,掌握相关的书写原理是解答关键,(3)因二氧化硫少量,所以有次氯酸生成为易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
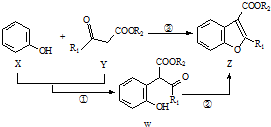 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述错误的是( )| A. | 反应①属于加成反应 | |
| B. | W能发生加成、水解、氧化反应 | |
| C. | X在一定条件下可发生缩聚反应 | |
| D. | 一定条件下Z与足量H2反应后所得产物中至少含有4个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
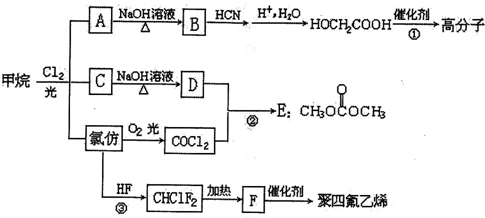

 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$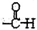
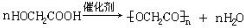 ②
②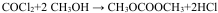
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
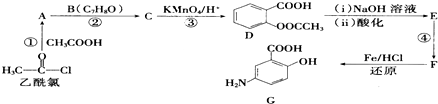
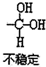
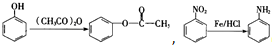 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
.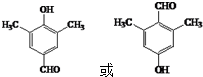 (写出其中一种结构简式).
(写出其中一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

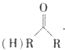 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$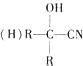 $→_{H+}^{H_{2}O}$
$→_{H+}^{H_{2}O}$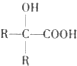
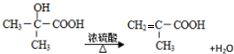
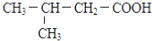 B.
B.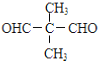 C.
C.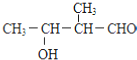 D.
D.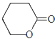
 .
. )可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式)
)可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
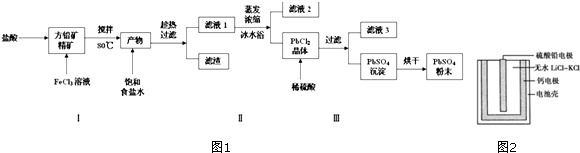
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
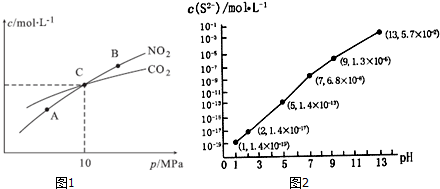
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com