
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )
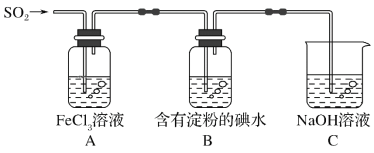
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2。
请根据要求回答下列有关问题:
(1)以上物质中属于电解质的是________;属于非电解质的是__________。(填序号)
(2)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有的阳离子是______,发生反应的离子方程式为_____________________________________________________。
(3)检验②溶液中阳离子的试剂是________________,证明其存在的现象是____________。
(4)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________ nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某同学为了探究锌与硫酸反应过程中的速率变化,在 400mL 稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
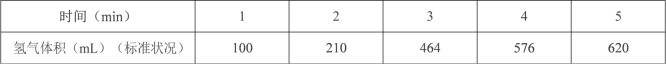
①哪一时间段反应速率最大_______min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”), 原因是________。
②求 3~4 分钟时间段以盐酸的浓度变化来表示的该反应速率________设溶液体积不变)。
(2)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回 答下列问题:
①硫酸铜溶液可以加快氢气生成速率的原因是_______。
②实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与实验中 CuSO4 溶液起相似作用的是_______。
③要减慢上述实验中气体产生速率,可采取的合力措施有_______、_______(答两种)。
(3) 某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图。
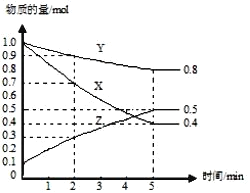
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是_______(填字母)
A.Y 的体积分数在混合气体中保持不变 B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变 D.容器内气体的总质量保持不变E.生成 1 mol Y 的同时消耗 2 mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是

A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①Na2O2 ②O2 ③HClO ④H2O2 ⑤Cl2 ⑥NaClO ⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_________。
(3)属于离子化合物的有______种。
(4)Na2O2、HClO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程:_________________________。
②写出Na2O2与H2O反应制备O2的化学方程式:____________________________________。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8g H2O2参加反应,则转移电子数目为_________,生成标准状况下O2体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化说法正确的是

A. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
B. 根据如图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,过程中向外界放出热量为E2-E3
C. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D. 已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H=-393.5kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1641.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备备受人们的关注。
(1)一定温度下,在2L恒容密闭的容器中充入2.0molN2O5发生反应:2N2O5(g)![]() 4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。

①已知:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol
2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol
则反应2N2O5(g)===4NO2(g)+O2(g)的△H=________。
②下列不能说明该反应已达平衡状态的是___(填序号)。
A.v正(N2O5)=2v逆(O2)
B.混合气体密度不变
C.混合体平均摩尔质量
D.NO2的体积分数不变
③该反应自发进行的条件是____(填“高温”或“低温”),实验Ⅲ中:a点v逆(O2)____(填“<”或“>”)b点v逆(O2)。
④实验Ⅱ从反应开始至平衡时,v(O2)=____mol/(L·min)。
⑤列式并计算该反应在800℃时的平衡常数K=_______。
(2)1840年Devil用干燥的氯气通过干燥的硝酸银,反应得到N2O5。该反应的氧化产物是一种气体,该反应的化学方程式为_______。
(3)N2O5也可采用“电解法”制备,装置如图所示。

则N2O5在电解池的____(填“阴极”或“阳极”)室生成,其电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室以下图所示的仪器和药品,进行氯气和铜粉反应的实验(部分夹持装置已省略).请按要求回答下列问题:

(1)装置A烧瓶中发生反应的化学方程式为________________________。
(2)按气流方向连接各仪器接口的顺序是(填接口字母):
a→_____、_____→_____、_____→f→g→_____
(3)装置C中饱和食盐水的作用是__________________________。
(4)装置B中发生反应的离子方程式为_____________________________。
(5)加热装置D时,铜粉发生反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 随着 HCl 的通入 c(H+)/c(H2A)先减小后增大
C. 将等浓度等体积的 Na2A 与 H2A 溶液混合后,溶液显碱性
D. pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com