
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ?mol-1) | 414 | 489 | 565 | 155 |
| A、放热485 kJ |
| B、吸热485 kJ |
| C、放热1940 kJ |
| D、吸热1940 kJ |
| 1940KJ |
| 4 |


科目:高中化学 来源: 题型:
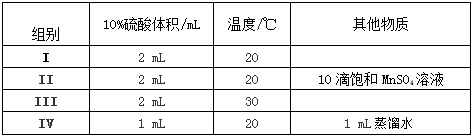
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾净水和家用消毒剂的消毒原理相同 |
| B、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| C、铝合金的广泛使用是因为人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、钒氮合金钢是“鸟巢”的主要材料之一,其熔点、硬度和强度均高于纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,2.8 gN2和CO的混合气体所含电子数为1.4NA | ||
| B、标准状况下,22.4 LCCl4含有的分子数目为NA | ||
C、1 L O.1 mol?L-1NaHCO3溶液中含有0.1NA个HCO
| ||
| D、在电解精炼粗铜的过程中,当转移电子数为 NA时,阳极溶解32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
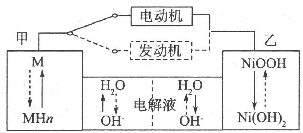 第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.其电路工作原 理如图所示.下列说法中正确的是( )
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.其电路工作原 理如图所示.下列说法中正确的是( )| A、电池充电时,OH-由甲侧向乙侧移动 |
| B、甲放电时为正极,充电时为阳极 |
| C、放电时正极的电极反应式为MHn-ne-═M+nH+ |
| D、汽车下坡时发生图中实线所示的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①②③⑤ |
| C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| D、Fe溶于稀硫酸:Fe+3H+=Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
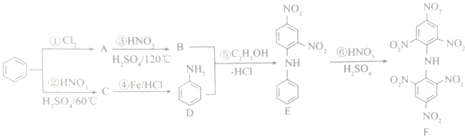
查看答案和解析>>
科目:高中化学 来源: 题型:
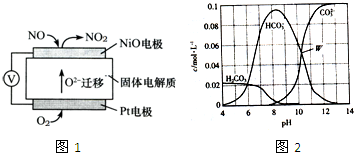 根据化学反应原理,回答下列问题:
根据化学反应原理,回答下列问题:c(HC
| ||
c(C
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com